Майя Бакрадзе — о том, как не пропустить серьезную угрозу при лечении детских инфекций

Главный научный сотрудник лаборатории разработки новых технологий диагностики и лечения болезней детского возраста НМИЦ здоровья детей, эксперт ВОЗ, д.м.н. Майя Бакрадзе рассказала «МВ» о главных ошибках, которые допускают детские врачи в лечении инфекций, и алгоритмах, помогающих вовремя разглядеть настоящую опасность.
— Начнем с самых коварных инфекций. Какие опасные состояния проще всего пропустить или неверно диагностировать у ребенка в первые годы жизни?
— За время детства ребенок переносит примерно от 50 до 100 инфекций, это необходимо для выработки иммунитета. Подавляющее большинство этих болезней не наносят длительного ущерба здоровью — они опасны в основном для хроников.
В амбулаторных условиях перед педиатрами стоят два блока проблем. Первый связан с дифференциальной диагностикой вирусных и бактериальных инфекций, выявлением бэта-гемолитического стрептококка группы А при остром тонзиллите, диагностикой атипичных инфекций при пневмонии и бронхите. Второй блок — терапевтические проблемы, среди которых — обоснованность назначения антибиотиков.
Среди десятков ОРЗ есть опасные инфекции — туберкулез, дифтерия, корь, полиомиелит, коклюш, грипп, против которых уже давно проводится иммунопрофилактика. Но остаются еще опасные бактериальные возбудители — пневмококки, менингококки, гемофильная палочка типа b, стрептококки, которые иногда осложняют ОРВИ или поначалу имеют сходные симптомы. В России пока нет массовой вакцинации от менингококков и гемофильной палочки типа b, а пневмококковая вакцина защищает не от всех серотипов возбудителя.
Именно эти возбудители вызывают тяжелые бактериальные инфекции, которые таят смертельную угрозу для ребенка — и вовсе не из-за высокой температуры или кашля, которые обычно больше всего беспокоят родителей.
— В чем сложность диагностики таких инфекций у маленьких детей?
— Прежде всего, в условиях осмотра на дому нет возможности полноценно провести дифференциальную диагностику вирусных и бактериальных заболеваний. Поздняя диагностика, несвоевременное лечение тяжелой инфекции и ее последствий, необоснованное назначение антибиотиков и других лекарств — это следствие системы помощи на дому. Если у пришедшего на вызов врача есть отоскоп, то уже хорошо, потому что 65% детей на первом году жизни переносят отиты, и не посмотреть уши врач не имеет права. Но при той нагрузке, которая лежит на педиатрах, вряд ли они туда заглядывают, если только речь не о коммерческой клинике.
У врача должна быть возможность сразу исключить РС-вирус, если у ребенка имеется одышка, снижение сатурации. Или, сплошь и рядом видим, что годовалому ребенку назначается антибиотик — только потому, что не исключен гемолитический стрептококк. Часто нужен анализ мочи: 15% всех лихорадящих детей на первом году жизни переносят инфекцию мочевыводящих путей, значит, анализ мочи у малыша с лихорадкой — обязательное исследование. А что происходит? Врач приходит домой к ребенку, пока он посмотрит, пока выпишет направление, затем надо отнести мочу в поликлинику, и только через сутки–трое будет готов анализ, и мама опять вызывает врача, чтобы больному назначили лекарства.
Поэтому в корне необходимо менять практику осмотров острых больных, особенно лихорадящих. Они должны приезжать в поликлинику, где можно провести спектр быстрых экспресс-тестов, определить маркеры воспаления, сделать рентгеновский снимок.
Сейчас педиатр, имея в арсенале стетоскоп и, может быть, отоскоп, должен среди массы лихорадящих больных выявить детей с бактериальной инфекцией, при которой возможно этиотропное лечение, в первую очередь, антибактериальная терапия. В некоторых случаях оценить тяжесть состояния по данным непосредственного исследования сложно, так как симптомы тяжелых инфекций на первом месяце жизни скудны и неспецифичны.
— Тогда как не пропустить эти симптомы?
— Более 90% лихорадящих детей обращаются по поводу вирусных заболеваний. Выявление из общей массы больных с бактериальной инфекцией — основная и первоочередная задача педиатра. В ее решении используются как клинические признаки и симптомы, так и лабораторные маркеры.
Первый шаг — это учет клинических синдромов вирусных и бактериальных инфекций органов дыхания. Наличие катарального синдрома у лихорадящего ребенка снижает вероятность бактериальной инфекции. По нашим данным, лишь у 20% детей с катаром имелись бактериальные заболевания, тогда как в отсутствие катара у 73%. Вывод: отсутствие катарального синдрома у лихорадящего ребенка повышает шансы диагноза бактериальной инфекции! Определение катарального синдрома — второй шаг в решении этой задачи.

Сложнее всего проводить дифференциальную диагностику между вирусными инфекциями без катарального синдрома и бактериальными заболеваниями без локального очага. То есть у ребенка температура выше 38,5 ˚С и при первом осмотре нет признаков какого-либо заболевания: он не кашляет, нет одышки, хрипов в легких, нет обструктивного синдрома, у него не красное горло, нет насморка. У 1/5 лихорадящих детей до трех лет отсутствуют другие симптомы заболевания, позволяющие поставить диагноз лихорадки без видимого очага инфекции (ЛБОИ).
Лихорадка без очага инфекции — группа состояний, в которую, согласно международному консенсусу, включаются дети 3—36 месяцев с температурой >39 ˚С и дети до трех месяцев с температурой >38 ˚С при отсутствии других признаков заболевания.
Этиологическая структура ЛБОИ включает как вирусы (бессимптомные в первые дни энтеровирусные инфекции, герпес 1 и 6 типов, первичная герпетическая инфекция и др.), так и возбудители скрытой бактериемии. Лидер среди возбудителей бактериемии у детей от трех месяцев до трех лет — пневмококк (80% всех случаев), реже гемофильная палочка типа b, менингококк. У детей до двух месяцев чаще встречаются грамотрицательные возбудители — клебсиелла, энтерококки, E. coli.
Бактериемия — инвазия циркуляторного русла возбудителем, может сопровождаться лихорадкой, но проходит без признаков и симптомов нарушения кровообращения. Часто такую бактериемию называют «скрытой» или «оккультной», она предшествует развитию тяжелой бактериальной инфекции (начальная фаза ТБИ) — пневмонии, менингита, остеомиелита, сепсиса, гнойного синусита и др.).
Бактериемия появляется у 4—5% детей до трех лет с лихорадкой. В условиях вакцинации против пневмококка и гемофильной палочки типа b ее частота по миру снизилась до 0,5%.
Критерии высокого риска ТБИ:
- дети до трех месяцев жизни;
- температура >38 ˚С;
- дети 3—6 месяцев жизни с неполной иммунизацией;
- дети 3—6 месяцев жизни с нарушением общего самочувствия.
Основная задача педиатра, когда перед ним ребенок с ЛБОИ, — установить степень риска бактериемии/тяжелой бактериальной инфекции. И хотя ТБИ свойственны проявления токсикоза, на ранних фазах они могут быть неяркими. Признаки, характеризующие состояние ребенка, его реакция на окружающие стимулы, его активность — все это надежные предикторы бактериемии.
Неважно, какая это болезнь, особенно при первом осмотре — пневмония, или пиелонефрит — врач должен уметь определять признаки тяжести, чтобы из всех лихорадящих детей выделить ребенка, который требует дополнительного обследования. Особенно тщательно нужно оценивать признаки тяжести после того, как спадает температура. Важно обращать внимание не только на аппетит (при вирусной инфекции дети все равно хоть что-то едят, а при бактериальной — напрочь перестают есть), жажду или отказ от питья, но и на заинтересованность ребенка внешним миром. Когда мы осматриваем малыша, то пытаемся привлечь его внимание, не нападаем сразу со стетоскопом, а начинаем с ним заигрывать. И вот если он не интересуется, если он выраженно апатичный, — это тоже предиктор тяжести.
Признаки тяжести позволяют надежно отличить вирусную инфекцию от бактериальной, это третий шаг дифференциальной диагностики.
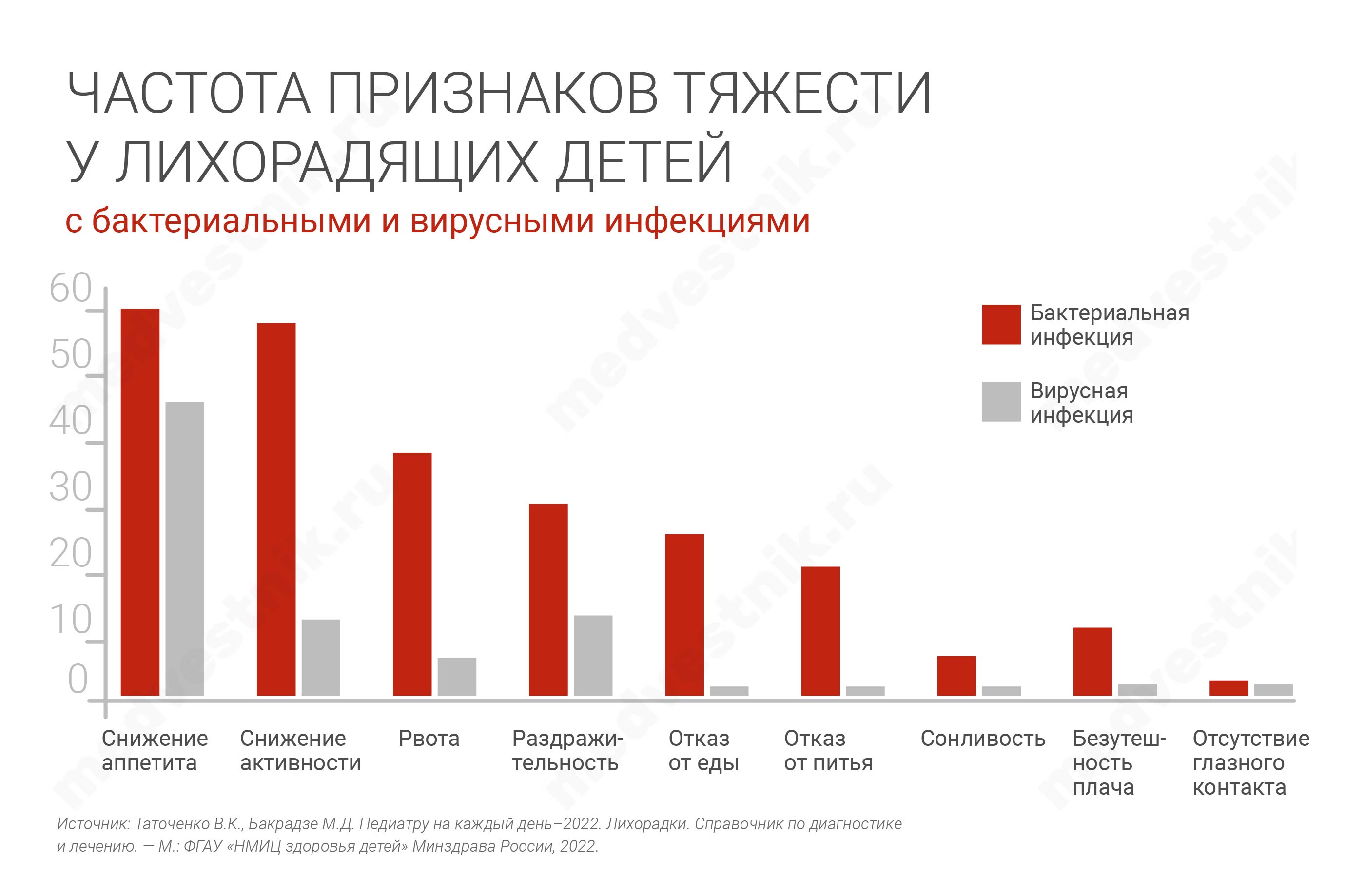
К этому следует добавить «больной вид», по оценке врача или матери, которая видит, что на этот раз ребенок переносит болезнь иначе. Эти признаки можно использовать для отбора детей, у которых потенциально может быть ТБИ, и их приоритетного обследования.
Но у детей первых трех месяцев жизни клинические признаки интерпретировать бывает сложно. Тогда можно использовать Рочестерские критерии низкого риска тяжелой бактериальной инфекции. Они позволяют при температуре выше 38 ˚С не назначать антибиотик при следующих условиях:
- если речь о доношенном ребенке, который ранее не получал антибиотики;
- если он не имеет физикальных симптомов бактериальной инфекции: нет отита, одышки, нет рвоты и т.д.;
- если число лейкоцитов в крови от 5 х 15 на 109, число палочкоядерных менее 1500 х 109, и если в осадке мочи менее 10 лейкоцитов в поле зрения.
Среди детей с этими критериями лишь у 0,67% развивается тяжелая бактериальная инфекция. Это в 30 раз реже, чем у детей с критериями высокого риска.
Дети с вирусными инфекциями, протекающими в первые дни как ЛБОИ, не выглядят токсичными, несмотря на лихорадку, у них часто сохранен аппетит, они активны, да и общее состояние страдает не сильно. Диагнозы ЕСНО-экзантемы и инфекций, вызванных вирусом герпеса 6-го типа, становятся очевидными лишь после появления сыпи при падении температуры. Стоматит при первичной ВПГ-1 инфекции в первые дни легко просмотреть на фоне лихорадки, но и эти пациенты не выглядят токсичными.
Лабораторная диагностика — четвертый шаг дифференциальной диагностики. При ЛБОИ в отсутствие четких симптомов лабораторные данные часто определяют тактику лечения. Высоким уровнем прогностичности в отношении бактериемии обладает лейкоцитоз ≥15 х 109/л, СРБ > 70 мг/л, ПКТ ≥ 2 нг/л.
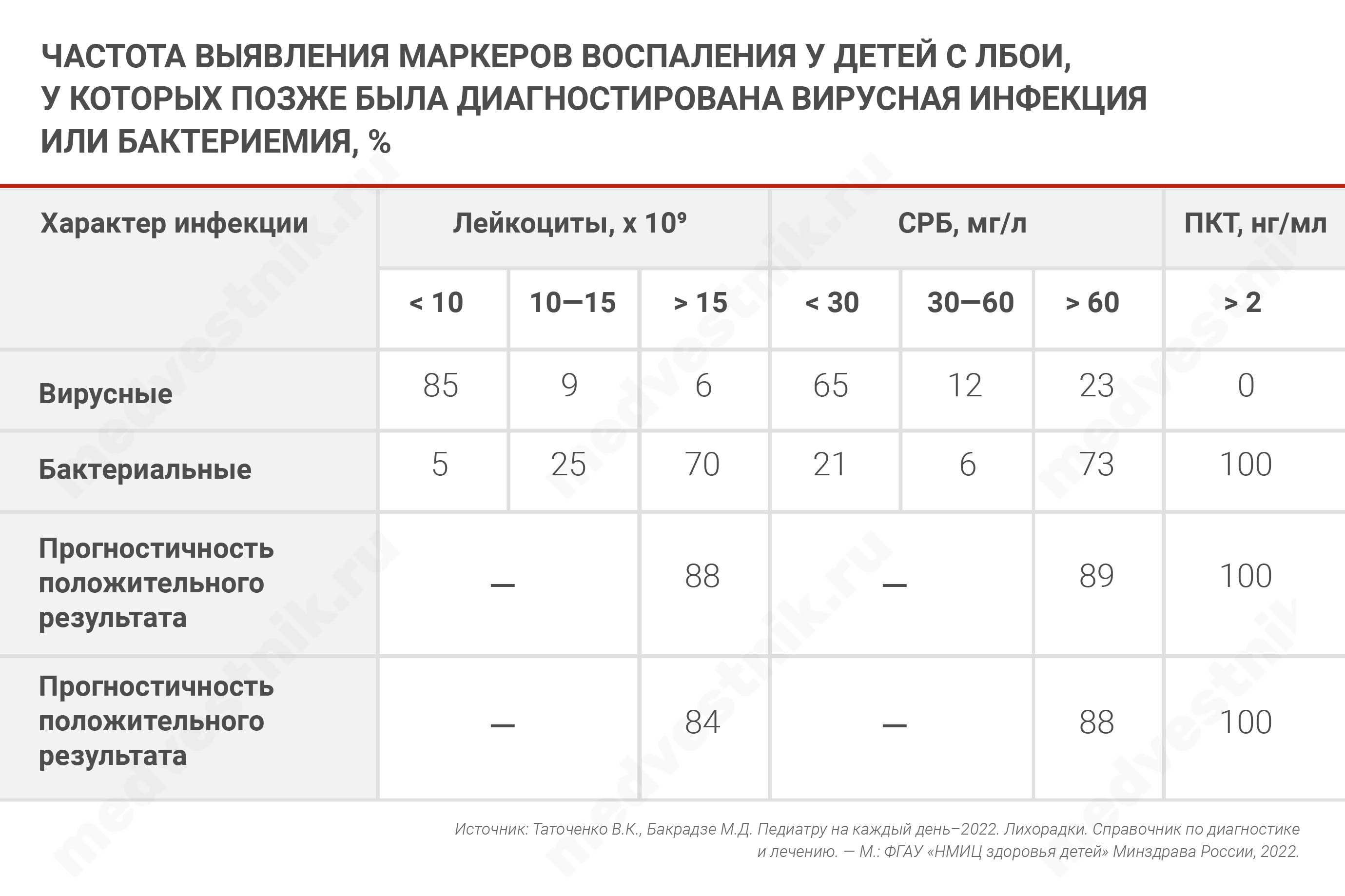
— А как должен выглядеть алгоритм действий врача, когда перед ним ребенок с ЛБОИ?
— Анамнез и осмотр на 80% решают вопрос о вероятности бактериальной инфекции у остро заболевшего лихорадящего ребенка.
После исключения отита, инфекции мочевых путей, пневмонии, менингита антибиотик вводится больным со следующими данными:
- с симптомами резкого токсикоза;
- при числе лейкоцитов >15×109/л;
- при числе нейтрофилов 10—15×109/л и СРБ >70 мг/л;
- ПКТ >2 нг/мл;
- при температуре >40 °C (для детей 0—2 месяцев — >39 °C) без признаков тяжести и числе лейкоцитов 10—15×109/л;
- СРБ 30—70 мг/л, если наблюдение затруднено.
Однако, есть нюансы:
- у 20% детей с бактериемией лейкоцитоз <15 х 109/л;
- в 1—2-й день болезни СРБ может быть низким, высокий СРБ обычно сопровождает лейкоцитоз выше 15 х 109/л;
- ПКТ надежнее: его уровень выше 2 нг/мл повышается в ранние сроки бактериальной инфекции и редко — при вирусных инфекциях, даже при лейкоцитозе 15—25 х 109/л.
Основные препараты для лечения бактериемии и ТБИ: цефтриаксон в дозе 80—100 г/кг/сут или амоксициллин/клавуланат 90 мг/кг/сут.
При ЛБОИ у детей в возрасте до двух месяцев в связи с высоким риском инфицирования листериями и энтерококком цефалоспорины комбинируют с ампициллином.
Антибиотики точно не показаны, если:
- отсутствует повышение маркеров (СРБ, ПКТ, лейкоциты в анализах крови и мочи);
- нет симптомов тяжести;
- при стоматите;
- если есть изменения на дужках (микровезекулы при герпангине).
Исходы и прогноз. При вирусной этиологии ЛБОИ исход, как правило, благоприятный, при бактериемии — зависит от сроков назначения антибиотика: своевременное адекватное лечение часто позволяет избежать развития ТБИ и приводит к быстрому выздоровлению.
Профилактика. Вакцинация против пневмококковой и гемофилюсной инфекций, а также гриппа существенно сокращает частоту ЛБОИ.
Еще несколько подсказок, полезных для диагностики:
- немедленное начало лечения при подозрении на бактериемию до получения результатов посева крови обрывает процесс либо облегчает развившуюся ТБИ;
- даже единичные петехии на коже у больного с ЛБОИ должны насторожить в отношении менингококцемии;
- на пиелонефрит у ребенка с ИМП указывают признаки тяжести (рвота, отказ от питья, беспокойство и др.), высокие уровни маркеров воспаления, увеличение размеров почки на УЗИ, бактериурия даже при умеренном мочевом синдроме;
- диагностическое значение имеют сроки купирования лихорадки: при бактериемии оно наступает в течение 12—24 часов от начала терапии. При сохранении лихорадки более 48 часов следует вновь оценить клинические и лабораторные данные;
- сыпь при вирусе герпеса 6-го типа и энтеровирусных инфекциях обычно появляется на 3—5 день лихорадки на фоне падения температуры.
— Какие ошибки в диагностике и лечении инфекционных болезней встречаются чаще всего?
— Основная ошибка при выборе лечения — злоупотребление антибиотиками при ОРВИ и бронхите — с одной стороны, и неверный выбор антибиотиков — с другой.
Всех возбудителей серьезных инфекций можно разделить на две группы. Первая — «типичные бактерии» (пневмо-, стрепто-, менингококки, Haemophilus influenzae), они не чувствительны к макролидам и требуют назначения пенициллинов или цефалоспоринов. Вторые — «атипичные» (микоплазма, реже хламидии) чувствительны только к макролидам.
Мы выявили, что более половины педиатров назначают препараты, к которым возбудители не чувствительны. Причем для верного решения не нужны микробиологические данные — есть достаточно четкие клинические признаки, позволяющие сделать правильный выбор.
Еще одна ошибка — маленькая доза. Возбудители повышают резистентность к антибиотикам, ситуация хорошо изучена и дозы препаратов к ней адаптированы.
Кроме того, неоправданное лечение антибиотиками связано с ошибками в трактовке анализов на инфекцию атипичными возбудителями. Необходимо помнить, что атипичные возбудители вызывают бронхиты, пневмонии с достаточно типичной клиникой, и если она отсутствует, диагностические тесты и назначение макролидов не показаны.
Нельзя не сказать о наличии большого числа так называемых иммуномодуляторов и гомеопатических средств, позиционируемых и как противовирусные. Мы постоянно сталкиваемся с ситуацией, когда врач, вместо того чтобы лечить ТБИ, «модулирует иммунитет», теряя время для эффективной терапии. Эти препараты не указаны в клинических рекомендациях.
Отдельная большая проблема — неправильные трактовки рентгенограмм при подозрении на пневмонию, их гипердиагностика, чрезмерное назначение КТ.
«Золотой стандарт» в диагностике острой пневмонии — рентгенологическое исследование. Именно на рентгене мы видим, надо нам повторять курс терапии или нет. Разрешительная способность КТ огромная, соответственно — изменения в легких видны гораздо дольше. Но это не значит, что ребенка надо продолжать лечить или менять антибиотик1.
— А помимо неверного подхода к снимкам, что еще может сбить с толку врача при выявлении внебольничной пневмонии?
— Критерии диагностики внебольничной пневмонии давно изучены, но на практике выявить ее непросто: среди направляемых на госпитализацию детей с этим диагнозом пневмония подтверждается лишь у каждого десятого.
Причина гипер- и гиподиагностики в том, что физикальные симптомы на самом деле малоинформативны. К тому же наиболее частые признаки пневмонии — кашель и фебрильная лихорадка — обычно сопровождают и ОРВИ.
При гиподиагностике самая опасная ошибка связана с тем, что диагноз «немой» внебольничной пневмонии без хрипов ставится поздно, на 5—7 день болезни. Такое может произойти, если врач проигнорировал стойкий фебрилитет, признаки тяжести (рвота, адинамия, отказ от еды и питья) и кряхтящее, стонущее дыхание, принимаемое за обструкцию. В совокупности со снижением температуры это верный путь к неблагоприятному исходу.
При гипердиагностике диагноз пневмонии часто ошибочно выставляется при других ОРЗ и астме. Наличие катара, а тем более обструктивного синдрома скорее говорит против диагноза пневмонии. Многих пугает температура ≥40 ºС, но и она сама по себе о пневмонии не говорит.
Обильные хрипы при стойком фебрилитете расценивают как признак типичной пневмонии, хотя это основной признак атипичной пневмонии.
С учетом этих трудностей эксперты ВОЗ предлагают учитывать общие нарушения — в частности, угрожающие жизни признаки (цианоз, дегидратация, нарушения сознания), которые характерны для тяжелых пневмоний.
Другие общие признаки тяжести, позволяющие отличить бактериальную инфекцию от вирусной, — это снижение аппетита и активности, рвота, раздражительность, отказ от еды и питья, сонливость, безутешность плача, отсутствие глазного контакта, и мы об этом уже подробно говорили.
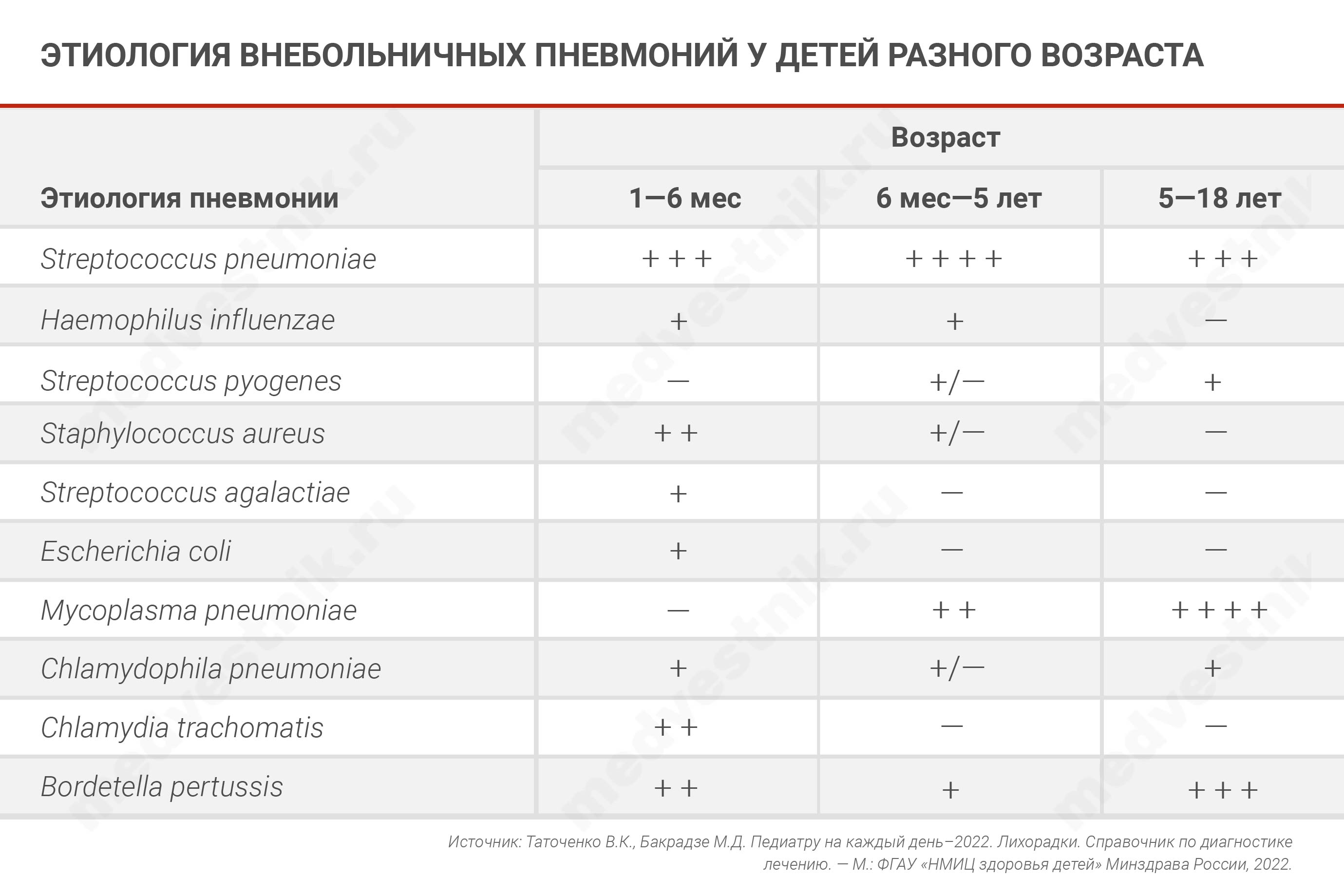
Кроме того, к сожалению, педиатры часто не различают атипичные и типичные пневмонии и назначают неэффективное лечение. Если основным возбудителем типичной ВП выступает пневмококк, то для атипичной ВП эту роль выполняет микоплазма.
Для вызванной микоплазмой ВП характерна стойкая лихорадка, но общее состояние страдает несильно, мало нарушая повседневный режим, и это нередко служит причиной позднего, на 6—9 день фебрилитета, обращения. Характерны для атипичной пневмонии конъюнктивит и обилие разнокалиберных влажных хрипов, что отличает ее от типичной ВП. Хрипы обычно асимметричны — больше на стороне поражения, иногда выявляются признаки обструкции.
.jpg)
— А какие ошибки в лечении пневмонии чаще всего допускают педиатры?
— Применение макролидов и цефиксима для стартовой терапии типичной пневмонии вопреки рекомендациям все еще практикует до половины педиатров. Около 80% врачей назначают β-лактамные антибиотики при атипичных пневмониях2.
Решение о стартовом антибиотике при ВП нужно принимать с учетом преобладающего вида флоры и ее резистентности «здесь и сейчас».
Препаратами выбора при типичных пневмониях остаются амоксициллин и амоксициллин/клавуланат, а также цефтриаксон, активные как в отношении пневмококков, так и редких возбудителей.
Дозировка амоксициллина и амоксициллина/клавуланата не должна быть ниже 50 мг/кг/сут, а в группах риска по устойчивости пневмококка — 90 мг/кг/сут, при атипичных пневмониях препарат выбора — макролид.
Важно: из-за роста устойчивости пневмококков к макролидам их использование при типичных пневмониях не рекомендовано.
Длительность лечения неосложненной типичной пневмонии — пять дней.
Длительность лечения атипичной пневмонии у детей до 12 лет — одна неделя, у подростков — две недели.

Что касается немедикаментозной терапии, то в остром периоде пневмонии физические методы удаления мокроты, как и электропроцедуры, ультразвук излишни. Они затягивают пребывание в стационаре и чреваты суперинфекцией. При плевритах после выписки стоит назначить пациенту ЛФК и дыхательную гимнастику.
— Бывает, что ребенок не успевает вылечиться от одной инфекции, как находит другую. Какие сочетания наиболее опасны и хуже всего поддаются диагностике и лечению?
— Сезонный комплекс возбудителей ОРВИ включает десятки одновременно циркулирующих вирусов. Это более 200 генетических групп из шести семейств и десяти родов. По клинической картине болезни, которые они вызывают, практически не различаются. Благодаря разным механизмам (изменчивость, множество серотипов, слабая иммуногенность) перенесенная ОРВИ не предотвращает повторное заражение, у детей может быть 5—10 таких эпизодов в год.
У преморбидно здоровых детей фебрильный период при ОРВИ, в отличие от гриппа, аденовирусной и бактериальных инфекций, редко превышает 2—3 дня, а симптомы проходят бесследно, не нанося существенного вреда. Кроме того, есть доказательства того, что повторные ОРВИ стимулируют созревание иммунной системы ребенка и способствуют преобладанию системы Т-хелпера 1-го типа.
Однако ОРВИ служат факторами риска бактериальной инфекции: нарушая мукоцилиарный клиренс, они могут способствовать попаданию условно патогенной флоры (пневмококк, Haemophilus influenzae) в несвойственную им нишу с развитием осложнения. Частота бактериальной суперинфекции может достигать 1—5%. Бактериальные осложнения, как правило, возникают уже в 1—2 дни болезни на фоне активной репликации вирусов.
Кроме того, респираторная инфекция может стать триггером обострения хронических заболеваний, чаще всего бронхиальной астмы и инфекции мочевыводящих путей. У детей с хроническими бронхо-легочными инфекциями, с иммунными дефектами ОРВИ сопровождается обострениями гнойного воспаления.
Из всех респираторных вирусов особенно опасен грипп. На его фоне частота вирусной и бактериальной (чаще всего обусловленной Streptococcus pneumoniae) пневмонии может достигать 12% среди заболевших детей.
Грозное осложнение — энцефалопатия с нарушениями сознания вплоть до комы, судорогами, атаксией. Грипп обостряет астму и большинство других хронических болезней. Отит у детей с гриппом, особенно в возрасте до двух лет, возникает в 18—40% случаев. У детей грипп может вызвать миозит с болями в мышцах (чаще ног), невозможностью ходить, повышением уровня креатинфосфокиназы.
Противовирусные препараты должны назначаться в первые 48 часов гриппа.
Озельтамивир (Тамифлю): р.о. дети более 1 года — 4 мг/кг/сут 5 дней (в США — с рождения 2 мг/кг/сут). Дети весом ≥40 кг и ≥ 13 лет — 75 мг — на два приема.
Профилактически р.о.: 1—2 мг/кг/сут не позднее 36 часов после контакта 7 дней или до 6 недель в эпидсезон.
Занамивир (Реленза) ингаляции — детям с 5 лет по две ингаляции (всего 10 мг) два раза в день, 5 дней.
Вакцинировать детей следует со второго полугодия жизни, первый раз их прививают дважды, в последующие годы однократно. Начало прививок — осенью, гриппозные вакцины можно вводить в один день с другими вакцинами (кроме БЦЖ), противопоказаний к ним практически нет.
1. Подробнее: Таточенко В.К., Бакрадзе М.Д. Педиатру на каждый день-2022. Лихорадки. Справочник по диагностике и лечению. М.: ФГАУ «НМИЦ здоровья детей» Минздрава России, 2022. С. 159—161.
2. Там же. С. 175.



Нет комментариев
Комментариев: 0