Анти-VEGF терапия: взгляд клинического фармаколога
Одна из таких молекул — фактор роста эндотелия сосудов (vascular endothelium growth factor, VEGF), открытый в 1983 году, но ставший основой для препаратов относительно недавно, после расшифровки тонких механизмов воздействия VEGF. Он структурно похож на хорошо изученный фактор роста тромбоцитов, отличаясь связью с пятью типами рецепторов, имеющих тирозин-киназную активность. Выявленные нарушения в системе регуляции VEGF признаются причиной многих физиологических, а также патологических процессов, включая эмбриогенез, репродукцию у женщин, беременность, а также рост опухолей, заживление ран, развитие ишемических и дистрофических болезней. Изначально физиологическая, защитная роль VEGF в отдельных случаях становится патологической, например, увеличивающей сосудистую проницаемость опухолей, способствующей неоваскуляризации и т.д.
Физиологически VEGF — полифункциональный цитокин, основной участник и дирижер процессов эмбриогенеза и ангиогенеза на раннем этапе развития эмбриона/плода. У взрослых людей он работает в сосудистой стенке, обеспечивая выживаемость эндотелиальных клеток, повышая сосудистую проницаемость, проявляя свойства вазодилататора, улучшая регенерацию клеток мышц, участвуя в ремоделировании миокарда при ишемии и перегрузках, а также в процессах репарации и костеобразования. Описаны и другие эффекты, полезные, но и способные запускать некоторые патологические механизмы, например, участие в развитии коллатерального кровообращения при гипоксии и ишемии, что представляется обязательным для выживания клеток в условиях гипоксии и для улучшения кровообращения и метаболизма заживающих тканей.
VEGF человека представлен несколькими группами белка (A, B, C, D), также выделен плацентарный фактор роста PIGF. Самый изученный из них VEGF-A, экспрессируемый в большом количестве паренхиматозными и стромальными клетками при ангиопатиях различного генеза (ишемия, метаболические нарушения и т.п.). Например, у пациентов с сахарным диабетом в моче и в плазме крови отмечается повышение уровня VEGF-А.
На уровне органа зрения, в сетчатке, синтез VEGF регулируется клетками пигментного эпителия, клетками Мюллера, астроцитами, перицитами, эндотелиоцитами и ганглиозными клетками. Находясь под ауто- и паракринными механизмами регуляции, он избирательно активирует пролиферацию и миграцию как самих эндотелиальных клеток, так и их предшественников. Именно VEGF повышает проницаемость сосудов, стимулирует вазодилатацию посредством повышения выработки оксида азота, что обеспечивает трофику и выживание клеток пигментного эпителия сетчатки, способствуя структурной целостности тканей. Суммарно эти эффекты описываются как антинейродегенеративное действие, препятствующее гибели клеток сетчатки из-за ишемии и реперфузии.
Гиперпродукцию VEGF называют главной виновницей усиления проницаемости сосудов сетчатки, развития макулярного отека, а также неоваскуляризации сетчатой оболочки при сахарном диабете. При диабетической ретинопатии основной причиной активации синтеза VEGF, а также экспрессии его рецепторов, считается гипоксия/ишемия сетчатки. Также выработка VEGF и его рецепторов увеличивается из-за биохимических аномалий, обусловленных гипергликемией: кумуляции продуктов гликирования, стресса эндоплазматического ретикулума, свободных радикалов. Также концентрация VEGF нарастает при влажной форме дегенерации макулы, а также после тромбоза вен сетчатки. Препараты-ингибиторы VEGF разделяют на блокаторы самого интерлейкина и/или его рецепторов и рассматривают в качестве самостоятельного средства, а также как дополнение к лазерному лечению и применению у пациентов с дегенерацией макулы триамцинолона. Основной эффект применения ингибиторов VEGF достигается торможением роста новых патологических сосудов, имеющих высокую проницаемость стенки, снижением сопутствующих экссудации и воспаления.
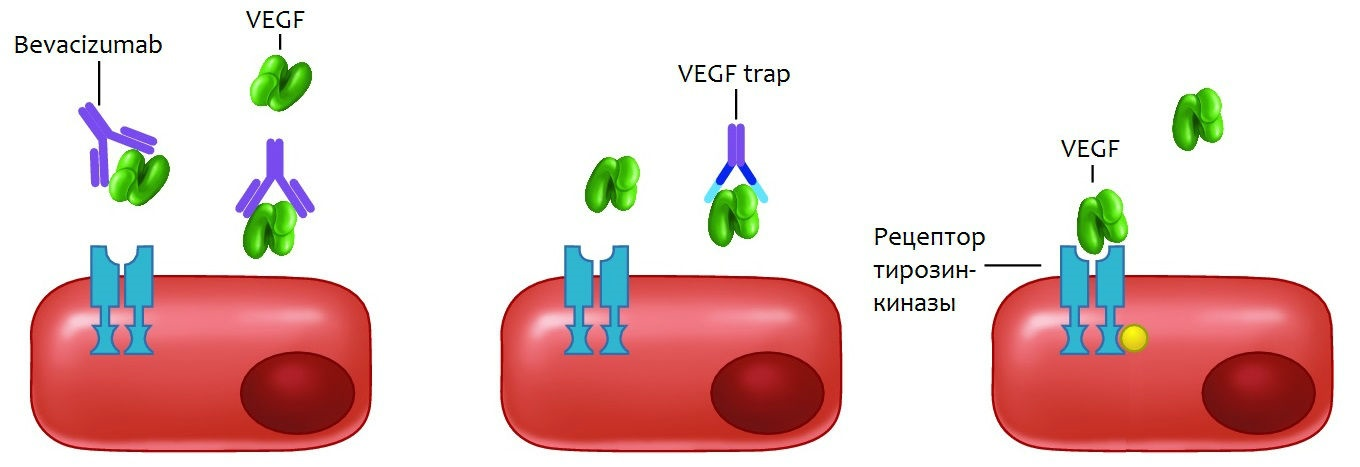
Рисунок 1. Схема мишеней воздействия анти-VEGF препаратов
Ингибиторы VEGF
Ингибиторы VEGF различаются некоторыми аспектами, связанными с их получением, а также деталями структуры веществ и специфичности по отношению к различным изоформам регулятора. Действие препаратов анти-VEGF (ранибизумаб, бевацизумаб, пегаптаниб) обусловлено непосредственным связыванием с фактором роста, подавлением экспрессии гена VEGF либо его рецептора. К настоящему моменту II–IV фазы клинических исследований терапии ВМД прошли: бевацизумаб, пегаптаниб, ранибизумаб, афлиберцепт. Большинство из них официально одобрены в качестве средств лечения возрастной дегенерации макулы.
Ранибизумаб
Ранибизумаб изначально разрабатывался исследователями как средство, адресованное офтальмологам. Этот ингибитор VEGF был разрешен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для применения при лечении возрастной влажной дегенерации макулы. Сегодня это единственный препарат с анти-VEGF действием, зарегистрированный в России. Его эффективность в лечении отека макулы доказана серией рандомизированных исследований, проведенных с охватом многих офтальмологических центров.
Бевацизумаб
Этот анти-VEGF препарат в основном применяется в онкологии для лечения злокачественных опухолей (метастатический колоректальный и почечноклеточный рак, некоторые варианты рака легкого, рецидивирующая глиобластома, персистирующий, рецидивирующий или метастатический рак шейки матки, эпителиальный рак яичников, маточных труб или первичный рак брюшины), в РФ его применение в офтальмологии не имеет официального статуса, но оценке эффективности бевацизумаба в терапии влажной формы ВМД уже посвящено более 40 клинических исследований. Наиболее свежие из них направлены на сравнение эффекта бевацизумаба и кортикоидов (триамцинолон, дексаметазон) в лечении неоваскулярной макулодистрофии.
Пегаптаниб
Этот анти-VEGF препарат разрешен для лечения неоваскулярной ВМД в США и европейских странах, его эффективность подтверждена рядом исследований. Согласно полученным данным, введенный в дозе 0,3 мг пегаптаниб значимо улучшает остроту зрения, результат длится до шести недель после инъекции. Длительный эффект достигается введением не менее трех инъекций в течение полугода.
Афлиберцепт
Это препарат с самой широкой анти-VEGF активностью, воздействующий на широкий спектр вариантов VEGF: A, VEGF-B и PlGF. В ряде стран и в России одобрен для применения в терапии влажной неоваскулярной дегенерации макулы, а также метастатических опухолей прямой кишки. Исследования афлиберцепта, как средства лечения ВМД, стали проводиться позднее остальных анти-VEGF препаратов.
Бролуцизумаб
В 2019 году был зарегистрирован бролуцизумаб — фрагмент моноклонального антитела, который в два раза меньше по размеру, чем ранибизумаб. Небольшой размер дает возможности молекуле проникать не только через слои сетчатки, но и доходить до хориоидеи. В двух пилотных исследованиях 2021 года отмечена сравнимая эффективность бролуцизумаба с афлиберцептом в отношении улучшения или сохранения зрения.
Фарицимаб
Последний из зарегистрированных препаратов (2022 год) — фарицимаб. Препарат представляет собой гуманизированное биспецифическое антитело, относящееся к классу иммуноглобулинов G1 (IgG1), которое действует посредством ингибирования двух различных путей, нейтрализуя как Ang-2, так и фактор роста эндотелия сосудов А (VEGF-A). Ang-2 снижает стабильность сосудов, способствуя дестабилизации эндотелия, потере перицитов и патологическому ангиогенезу и тем самым усиливая транссудацию и воспаление. Он также повышает чувствительность кровеносных сосудов к активности VEGF-A, что приводит к их дальнейшей дестабилизации. Ang-2 и VEGF-A отличаются синергизмом действия в отношении увеличения проницаемости сосудов и стимуляции неоваскуляризации. Двойное ингибирование Ang-2 и VEGF-A фарицимабом снижает проницаемость сосудов и уменьшает воспаление, подавляет патологический ангиогенез и восстанавливает стабильность сосудов.
Особенностью фарицимаба можно считать больший интервал между инъекциями (до 4 мес), в отличие от других препаратов, которые приходится вводить в глаз через каждые месяц-два.
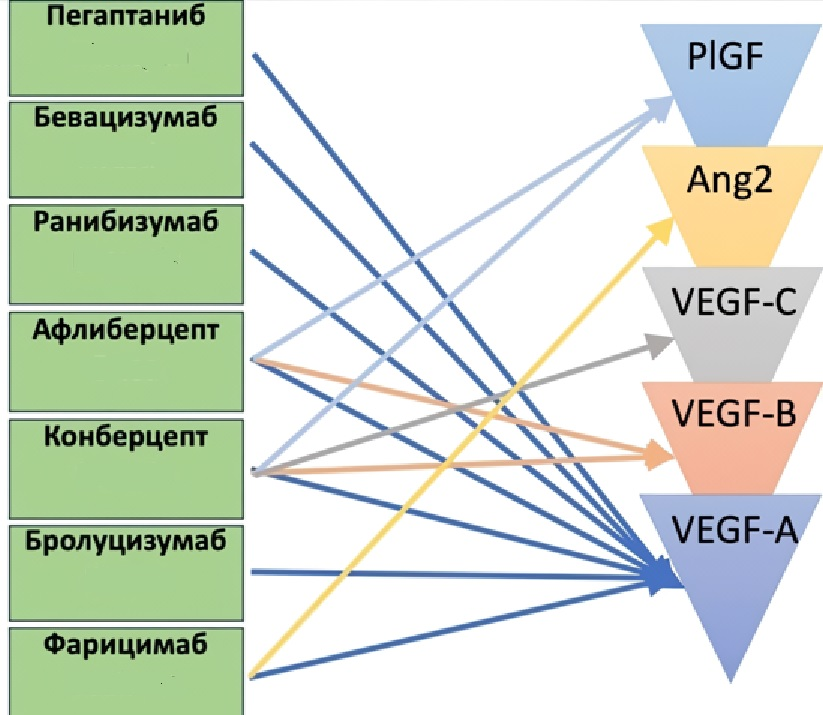
Рисунок 2. Мишени воздействия различных anti-VEGF препаратов. PIGF (placental growth factor) — плацентарный фактор роста. Ang2 (angiopoetin2) — ангипоэтин 2. VEGF(A, B, C) (vascular endothelial growth factor) — эндотелиальный фактор роста сосудов (А, В, С)
Среди анти-VEGF средств последнего поколения, которые только проходят необходимые исследования для последующего применения в качестве терапии макулярного отека, стоит отметить бевасираниб. Это препарат, основу которого составляют РНК, подавляет ген, синтезирующий VEGF. Он также вводится интравитреально.
Инъекции anti-VEGF препаратов
Эта группа препаратов при теарапии офтальмологической патологии применяется локально (местно). Внедрение в практику интравитреальных инъекций ингибиторов VEGF открыло новые возможности лечения макулодистрофии. Использование анти-VEGF терапии как монотерапии или в сочетании с ЛКС делает менее выраженным отек макулы, способствует повышению остроты зрения, замедляет прогрессирование патологических процессов. Положительные результаты проведенных рандомизированных исследований применения бевацизумаба, пегаптаниба, афлиберцепта доказывают их высокую эффективность. Планируется проведение клинических исследований для сравнения эффективности этих препаратов в лечении дегенерации макулы.
Для введения анти-VEGF препаратов наиболее целесообразным считается интравитреальный способ, так как он наиболее эффективен в доставке вещества непосредственно к сетчатой оболочке. При таком способе введения больший процент действующего вещества (до половины) остается в стекловидном теле, до сетчатки и сосудистой оболочки доходит до 13,2% всей дозы. Если применяется другой способ введения, например, субконъюнктивально, то к внутренним структурам глаза (стекловидное тело, сетчатка, сосудистая оболочка) доставляется до 5,5% от вводимой дозы.
Офтальмологические осложнения анти-VEGF терапии
Применение анти-VEGF препаратов в терапии офтальмологических заболеваний может приводить к возникновению ряда патологических состояний: отслойке сетчатки, повышению внутриглазного давления, эндофтальмиту, повреждению хрусталика. По данным исследований, частота таких осложнений составляет не более 1–1,5% всех случаев терапии.
Системные побочные эффекты тоже наблюдаются редко. Иногда возникают: повышение артериального давления, инфаркт миокарда, инсульт, протеинурия. Подобные реакции специалисты связывают с попаданием какого-то количества препарата в кровяное русло.



Нет комментариев
Комментариев: