Базисная терапия остеоартрита: современный взгляд на применение препаратов глюкозамина и хондроитина
Алексеева Л.И.1,2, Лила А.М.1,2
|
В статье освещены современные представления об использовании симптоматических средств замедленного действия (SYSADOA) при остеоартрите (ОА). Описаны механизмы их влияния, данные клинических исследований эффективности глюкозамина (ГЛ) и хондроитина сульфата (ХС) и их комбинации при ОА, подтверждающие наличие у этих препаратов симптоматического и структурно-модифицирующего действия. Рассмотрены последние рекомендации по лечению ОА лекарственными средствами этой группы, а также обоснования применения комбинированных препаратов хондроитина и ГЛ в качестве базисных средств на самых ранних стадиях развития ОА. Указано, что такая терапия должна быть длительной с учетом ее высокой безопасности, а также возможного снижения риска развития сердечно-сосудистых катастроф. Отмечено, что терапевтическими дозами ГЛ и ХС являются ≥1500 и ≥800 мг/сут., соответственно, обращено внимание на преимущество капсулированных форм SYSADOA ввиду их фармакокинетических особенностей. Ключевые слова: остеоартрит; рекомендации; симптоматические препараты замедленного действия; хондроитин; глюкозамин; комбинированные препараты. Контакты: Людмила Ивановна Алексеева; dr.alekseeva@gmail.com Для ссылки: Алексеева ЛИ, Лила АМ. Базисная терапия остеоартрита: современный взгляд на применение препаратов глюкозамина и хондроитина. Современная ревматология. 2021;15(2):112–119. DOI: 10.14412/1996-7012-2021-2-112-119. |
The article highlights the current status of symptomatic slow-acting drugs (SYSADOA) in osteoarthritis (OA). Mechanism of action, clinical studies data on the effectiveness of glucosamine (GA) and chondroitin sulfate (CS) and their combinations in OA, their positive symptomatic and structural-modifying effects, are described. The article provides the latest recommendations for the OA treatment with these two drugs and presents an argument for the combination therapy with both drugs as a background therapy in the earliest stages of OA. It is indicated that such therapy should be long-term due to its high safety and possible reduction of cardiovascular accidents risk as well. It is noted that therapeutic doses of CS and GA are ≥1500 and ≥800 mg per day, respectively, and encapsulated forms of SYSADOAs have advantages due to their pharmacokinetic features. Keywords: osteoarthritis; recommendations; symptomatic slow-acting drugs; chondroitin; glucosamine; combined drugs. Contact: Ludmila Ivanovna Alekseeva; dr.alekseeva@gmail.com For reference: Alekseeva LI, Lila AM. Osteoarthritis background therapy: current view on the glucosamine and chondroitin therapy. Sovremennaya Revmatologiya=Modern Rheumatology Journal. 2021;15(2):112–119. DOI: 10.14412/1996-7012-2021-2-112-119. |
В России, по данным официальной статистики за 2016 г., ОА занимает лидирующие позиции по распространенности среди всех ревматических заболеваний — 4 285 464 случая [2], что обусловливает большое число обращений за медицинской помощью и высокие затраты на нее.
Изучение показателей глобального бремени болезней (Global Burden of Disease; оценивалось 354 заболевания) выявило, что ОА страдает 303 (от 273 до 339) млн человек в 195 странах. При этом отмечается постоянный рост количества лет, прожитых в состоянии нетрудоспособности (Years lived with disability, YLDs) вследствие ОА: с 1990 по 2007 г. YLDs увеличилось на 63,1% (61,5–64,9), с 2007 по 2017 г. — на 31,4% (30,7—32,1), а экономические потери в 2017 г. в среднем достигли 9,6 млн долларов (4,8—19,1) [3].
ОА — возрастзависимое заболевание, его распространенность растет по мере увеличения продолжительности жизни, особенно в Европе, США и других развитых странах [4, 5]. Однако долголетие, вероятно, не единственная причина высокой заболеваемости ОА. По современным представлениям ОА возникает под действием множества генетических и средовых факторов. Изменения окружающей среды оказывают существенное влияние на повышение распространенности ОА. К наиболее важным факторам риска (ФР) развития первичного ОА относят: возраст, пол, гиподинамию и особенности питания. Воздействие этих факторов приводит к развитию ожирения, мышечной слабости, различных метаболических нарушений с поражением всех тканей сустава. I.J. Wallace и соавт. [6] на основании патоморфологических данных изучали связь ожирения с частотой ОА коленного сустава. Авторы показали, что среди умерших в последние несколько десятилетий, ожирением страдали 25% лиц по сравнению с 1% в прежние времена, при этом частота ОА коленного сустава при ожирении была в 2,2 раза выше (95% ДИ 1,6—3,0), чем у лиц без ожирения. Эти данные демонстрируют, что в настоящее время ожирение вдвое увеличивает риск возникновения ОА коленного сустава.
Ожирение играет важную роль в развитии и более быстром прогрессировании ОА [7, 8]. Жировая ткань как секреторный орган продуцирует разные адипоцитокины: лептин, резистин, висфатин и др., которые повышают синтез провоспалительных медиаторов — интерлейкина (ИЛ) 1b, ИЛ6, фактора некроза опуходи (ФНО) a и др. — в хондроцитах, остеобластах, синовиоцитах, поддерживающих воспаление низкой степени интенсивности, приводя к нарастанию катаболических процессов во всех тканях сустава и развитию заболевания. При метаболическом синдроме более чем в 2 раза возрастает вероятность развития ОА (отношение шансов, ОШ 2,24; 95% доверительный интервал, ДИ 1,38–3,64) [9]. Метаболические нарушения ассоциируются с инсулинорезистентностью, гипергликемией, артериальной гипертензией, избыточной массой тела, дислипидемией и гиперурикемией. Эти состояния, в свою очередь, рассматриваются как ФР развития ОА, причем от их числа зависит тяжесть течения заболевания. В 3-летнем исследовании установлено, что вероятность развития ОА коленных суставов повышается в 2,8 раза (р=0,039) при наличии двух компонентов метаболического синдрома и в 9,8 раз (р<0,001) при наличии трех компонентов [10].
ОА — мультиморбидное заболевание, поэтому при разработке тактики ведения таких пациентов нужно оценивать как сопутствующие заболевания, так и лекарственные средства, назначаемые для их лечения. Наличие у пациента с ОА нескольких болезней поднимает вопрос о полипрагмазии и необходимости учитывать не только возможные нежелательные явления тех или иных препаратов, но и их негативное взаимодействие. В 2020 г. на конгрессе Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis, ESCEO) были приведены данные о том, что при сахарном диабете 2-го типа существует 133 потенциальных серьезных взаимодействия лекарственных средств, а при депрессии — 89. Это тем более важно у пожилых больных ОА, у которых часто встречаются обе эти нозологии.
Современное лечение ОА направлено не только на уменьшение боли и улучшение функционального состояния суставов, но и на замедление прогрессирования заболевания с помощью комплексного воздействия нефармакологических и медикаментозных методов, способствующих снижению инвалидизации и улучшению качества жизни больных. Первые рекомендации (ACR) по лечению больных ОА коленных и тазобедренных суставов появились в 1995 г., затем последовательно для ОА коленных, тазобедренных суставов и суставов кистей были разработаны клинические рекомендации Европейской антиревматической лиги (European League Against Rheumatism, EULAR), совместные европейские и американские рекомендации по ведению больных с ОА под эгидой Международного общества по изучению остеоартрита (Osteoarthritis Research Society International, OARSI), рекомендации Ассоциации ревматологов России (АРР). Инициаторами создания рекомендаций были не только ревматологи, но и специалисты из других областей медицины, которые наиболее часто сталкивались с ведением больных ОА, о чем свидетельствуют рекомендации Американской академии хирургов травматологов-ортопедов (American Academy of Orthopaedic Surgeons, AAOS), Национального института здоровья и качества медицинской помощи Великобритании (National Institute for Health and Care Excellence, NICE), Российского научного медицинского общества терапевтов (РНМОТ), ESCEO, Американского общества практикующих врачей и др.
Как правило, во всех клинических рекомендациях на первом месте стоят нефармакологические методы, адаптированные к потребностям и предпочтениям пациента (образовательные программы, физические упражнения, коррекция массы тела и отклонения оси сустава), которые должны применяться на протяжении всего периода лечения. И с этим положением согласны все эксперты. Противоречия касаются в основном медикаментозной терапии, особенно использования симптоматических средств замедленного действия в терапии остеоартрита (Symptomatic Slow Acting Drugs for Osteoarthritis, SYSADOA).
Первый алгоритм ведения больных ОА коленных суставов в реальной клинической практике был создан ESCEO в 2014 г. Через 5 лет в Париже были представлены обновленные рекомендации ESCEO с учетом последних систематических обзоров, метаанализов и доказательной системы GRADE, в которых, как и в предыдущих рекомендациях, подчеркивалось, что SYSADOA должны назначаться сразу после установления диагноза ОА в качестве базисной терапии, поскольку они обладают противовоспалительным, анальгетическим действием и доказанным долгосрочным влиянием на заболевание [11, 12]. Однако в других руководствах, например в американских, эти препараты либо не рекомендуются, либо их использование имеет определенные ограничения. Эти противоречивые данные активно обсуждаются и EULAR, и другими научными обществами [13].
Существует несколько причин таких разногласий: высокая гетерогенность ОА и, как следствие, высокая гетерогенность популяции больных, включенных в метаанализы, что может влиять на эффективность проводимого лечения, а также высокая мультиморбидность. Важное значение имеет неоднородность самих SYSADOA (рецептурные, безрецептурные препараты, пищевые добавки), содержащих различные активные ингредиенты. Поэтому ESCEO особо подчеркивает, что следует использовать рецептурные препараты глюкозамина (ГЛ) и хондроитина, фармацевтическое качество и доказательная база которых не вызывают сомнений.
Среди препаратов SYSADOA наибольшая доказательная база имеется для хондроитина и ГЛ. Хондроитина сульфат (ХС) представляет собой важный компонент соединительной ткани, выполняющий обменные и биомеханические функции. Молекула ХС — это сульфатированный гликозаминогликан (ГАГ), состоящий из неразветвленных цепей с повторяющимися остатками N-ацетилгалактозамина, сульфатированных в 4-м и 6-м положениях, и глюкуроновой кислоты, что обусловливает ее полианионные свойства и участие в процессах транспорта воды, аминокислот и липидов в аваскулярных участках хряща. При пероральном приеме происходит быстрая абсорбция ХС из желудочнокишечного тракта (ЖКТ), в системный кровоток попадают преимущественно низкомолекулярные дериваты, до 90% принятой дозы и до 13% нативных молекул. Биодоступность ХС в среднем составляет от 10 до 20%. Максимальная концентрация ХС в крови наблюдается через 3—4 ч после приема, а в синовиальной жидкости — через 4—5 ч. Выводится препарат преимущественно почками. Эффективность ХС связана с его накоплением в тканях сустава, прежде всего в хряще и синовиальной жидкости, что было доказано в исследованиях с использованием радиоактивных меток [14]. Стабильная концентрация ХС в системном кровотоке достигается через 3—4 дня, однако клинический эффект проявляется через 8—12 нед. терапии, поэтому содержащие ХС препараты называются «симптоматическими средствами замедленного действия», в отличие от быстро действующих средств — нестероидных противовоспалительных препаратов (НПВП) и анальгетиков.
ХС увеличивает синтез коллагена и протеогликанов хондроцитами, ингибирует синтез ферментов эластазы и гиалуронидазы, повышает продукцию гиалуроната синовиальными клетками. В исследованиях in vitro ХС подавлял воспалительный процесс, ингибируя активацию ядерного фактора NF-kB, снижая синтез провоспалительных медиаторов. В ряде исследований было выявлено, что ХС может уменьшать индуцированную экспрессию матриксной металлопротеиназы (ММП) 13 в хондроцитах. Использование ХС в экспериментальных моделях также продемонстрировало эффективное ингибирование ММП3 и ММП9. ХС воздействует и на субхондральную кость при ОА, подавляя продукцию циклооксигеназы (ЦОГ) 2, простагландина Е2 (ПГЕ2) и ММП посредством ИЛ1b-стимулированных остеобластов (р<0,001). ХС уменьшает процессы резорбции субхондральной кости, снижая экспрессию RANKL и активируя синтез остеопротегерина. Таким образом, ХС оказывает плейотропное действие, влияя практически на все звенья патогенеза ОА.
Клиническая эффективность ХС в отношении уменьшения болевого синдрома и улучшения функционального состояния доказана во многих многоцентровых двойных слепых плацебо-контролируемых исследованиях. В работе, проведенной в Институте ревматологии, были подтверждены эффективность и хорошая переносимость ХС, причем достигнутый эффект сохранялся в течение 3 мес. после отмены препарата [15]. Сетевой метаанализ, выполненный в 2015 г., в очередной раз показал способность ХС уменьшать боль, улучшать функцию суставов у пациентов с ОА, а также его высокую безопасность [16]. Двухлетние исследования структурно-модифицирующего эффекта ХС у больных ОА коленного сустава выявили значимое стабилизирующее влияние ХС на ширину суставной щели [17, 18]. Результаты метаанализа, включавшего три рандомизированных контролируемых исследования (РКИ) продолжительностью до 2 лет, тоже указывают на статистически значимое снижение скорости сужения суставной щели — 0,13 мм (95% ДИ 0,06–0,19; р=0,002), что соответствовало силе эффекта 0,23 (95% ДИ 0,11–0,35; р=0,001) [19]. Изучение объема суставного хряща с помощью магнитно-резонансной томографии (МРТ) продемонстрировало, что терапия ХС обладает протективным действием в отношении структуры сустава [20]. В исследовании G. Verbruggen и соавт. [21] через 3 года терапии ХС у больных ОА суставов кистей не наблюдалось прогрессирования, в то время как в группе плацебо выявлено статистически значимое прогрессирование ОА межфаланговых суставов, особенно по числу образования новых эрозий — 8,8 и 29,4% соответственно. Еще в одном исследовании был подтвержден симптоматический эффект ХС при ОА этой локализации ОА [22].
ГЛ — аминомоносахарид, который входит в состав некоторых тканей, включая хрящ, и присутствует в структуре ГАГ, гепарансульфата, кератансульфата и гиалуронана. Биодоступность ГЛ при приеме внутрь составляет 25%. При приеме глюкозамина сульфата (ГС) в терапевтических дозах он поступает как в плазму, так и в синовиальную жидкость, при этом его концентрация в синовиальной жидкости составляет 3,22—18,1 мкмоль/дл, период полувыведения ГЛ — около 15 ч.
В классических экспериментальных моделях ГЛ стимулировал продукцию ГАГ и протеогликанов, ингибировал ИЛ1-индуцированную активность агреканазы в хондроцитах, замедляя деградацию агрекана. Описаны новые механизмы противовоспалительного действия ГЛ: подавление продукции ИЛ1b, индуцированной ЦОГ2 и ИЛ6, без влияния на ЦОГ1. Структурно-модифицирующее действие препарата (уменьшение повреждения хряща) было установлено в эксперименте на животных.
Необходимо отметить важность выбора формы препарата ГЛ и ХС. Как показали исследования фармакокинетики, ввиду особенностей молекулы ХС абсорбируется из ЖКТ путем парацеллюлярного транспорта из самых верхних отделов тонкой кишки [23]. В то же время ГЛ в большей степени всасывается из двенадцатиперстной кишки, и в меньшей — из тощей и толстой кишок [23]. Это означает, что лекарственная форма препарата ГЛ и ХС должна обеспечивать быстрое и полное высвобождение активных компонентов в желудке и верхних отделах кишечника. Следовательно, препараты в форме желатиновых капсул имеют некоторое преимущество, так как их желатиновая оболочка очень быстро разрушается под действием желудочного сока. В то же время при приеме таблетированных форм действующее вещество может высвобождаться уже в кишечной среде, по этой причине профили абсорбции ГЛ и ХС могут различаться в зависимости от лекарственной формы. Учитывая эти особенности, весьма сложно давать обобщенную оценку всем препаратам ХС и ГЛ в метаанализах, так как эффективность включенных в исследования препаратов может быть различной. Принимая во внимание особенности форм выпуска и их очевидную связь с фармакокинетикой ХС и ГЛ, целесообразно применение в клинической практике препаратов, имеющих статус лекарственного средства, а не биологически активной добавки.
Эффективность ГЛ при ОА показана во многих клинических исследованиях и обзорах. По данным Кокрановского обзора 2005 г. [24], включающего 20 РКИ, терапия ГС приводила к значимому уменьшению интенсивности боли в суставах и улучшению функции по индексам Лекена и WOMAC по сравнению с плацебо. В метаанализе P. Eriksen и соавт. [25] еще раз подтверждена эффективность ГЛ. Недавно JAMA [26] опубликовал большой систематический обзор (47 РКИ, n=22 037), также показавший, что ГС и ХС обладают структурно-модифицирующим действием: SMD (standardised mean difference) = -0,42, (95% ДИ от 0,65 до -0,19) и SMD = -0,20 (95% ДИ от -0,31 до -0,07) соответственно. Результаты работы J.R. Provenza и соавт. [27] обосновывают предположение о том, что эффективность глюкозамина гидрохлорида (ГГ) и ГС сопоставима. Последний сетевой метаанализ, в котором оценивалась эффективность препаратов, чаще всего назначаемых для лечения ОА коленного сустава (79 РКИ высокого качества, n=15 609), продемонстрировал, что ХС и ГЛ, имевшие статус лекарственных препаратов, витамин D, внутрисуставное введение гиалуроновой кислоты и комбинация гиалуроновой кислоты и триамцинолона статистически значимо уменьшали боль и улучшали функцию суставов (см. рис.). Дополнительный анализ данных выявил, что ХС позитивно влиял на скованность при ОА коленного сустава: SMD = -0,4 (95% ДИ от -0,74 до -0,05), а кристаллический ГС и ХС замедляли сужение суставной щели при ОА коленных суставов: средняя разница сужения составила 0,27 мм (95% ДИ 0,09—0,46) для ГС и 0,13 мм (95% ДИ 0,01—0,25) для ХС по сравнению с плацебо [28].
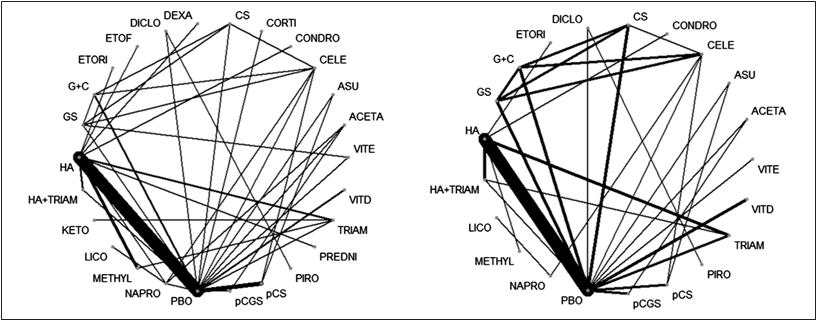
График эффективности лечения ОА коленного сустава: а – влияние на боль; б – влияние на функцию (ширина каждого края пропорциональна обратной дисперсии суммарного эффекта каждого прямого сравнения лечения). ACETA – ацетаминофен/парацетамол; ASU – неомыляемые соединения авокадо и сои; CELE – целекоксиб; CONDRO – кондротид; CORTY – кортивазол; CS – ХС; DEXA – дексаметазон; DICLO – диклофенак; ETOF – этофенамат; ETORI – эторикоксиб; G + C – ГС + ХС; GS – ГС;
HA – гиалуроновая кислота; НА + TRIAM – гиалуроновая кислота + триамцинолон; КЕТО – кеторолак; LICO – ликофелон; METHYL – метилпреднизолон; NAPRO – напроксен; PBO – плацебо; pCGS – рецептурный кристаллический ГС; pCS – рецептурный ХС; PIRO – пироксикам; PREDNI – преднизолон; TRIAM – триамцинолон; VITD – витамин D; VITE – витамин Е (адаптировано из [28]).
Diagram of the effectiveness of knee OA treatment: а – influence on pain; б – influence on the function (the width of each edge is proportional to the reverse dispersion of the total effect of each direct comparison of treatment). ACETA – acetaminophen/paracetamol; ASU – unsaponifiable compounds of soya beans and avocado; CELE – celecoxib; CONDRO – condrotide; CORTY – cortyvazol; CS – CS; DEXA – dexamethasone; DICLO – diclofenac; ETOF – etofenamato; ETORI – etoricoxib; G + C – GS + CS; GS – GS; HA – hyaluronic acid; НА + TRIAM – hyaluronic acid + triamcinolone; КЕТО – ketorolac; LICO – licofelone; METHYL – methylprednisolone;
NAPRO – naproxen; PBO – placebo; pCGS – prescription form of crystalline GS; pCS – prescription form of CS; PIRO – piroxicam; PREDNI – prednisone; TRIAM – triamcinolone; VITD – vitamin D; VITE – vitamin Е (adopted from [28]).
Учитывая доказанную эффективность и хорошую переносимость ГЛ и ХС (особенно при наличии мультиморбидности и связанной с ней полипрагмазии), а также данные об их синергическом действии, стали разрабатываться препараты, содержащие комбинацию ГЛ и ХС. Эффективность такой комбинации подтверждается экспериментальными и клиническими данными. В эксперименте установлено, что комбинированная терапия ХС и ГГ увеличивала продукцию ГАГ хондроцитами на 96,6% по сравнению с 32% при монотерапии и подавляла синтез некоторых медиаторов дегенерации хряща, в частности желатинолитическую активность ММР9, концентрацию ММР13 и уровень кератансульфата в тканях. I. Damlar и соавт. [29] сравнивали влияние ГЛ + ХС и трамадола на уровень маркеров воспаления в синовиальной жидкости височно-нижнечелюстного сустава у 34 пациенток. Было показано, что на фоне комбинированной терапии в синовиальной жидкости существенно снизилось содержание ПГE2 по сравнению с его исходным значением (7,35±0,36 против 6,58±0,67 пкг/мл), а концентрации ИЛ1b, ИЛ6 и ФНОa уменьшились незначительно. При терапии трамадолом статистически значимого снижения уровня маркеров воспаления не обнаружено, а содержание ИЛ1b и ИЛ6 в синовиальной жидкости даже увеличилось. Таким образом, в этой работе подтверждено противовоспалительное действие ГЛ и ХС [29].
Первоначально сочетанное применение этих препаратов проводилось на небольших выборках больных. Так, в двойном слепом плацебо-контролируемом исследовании при использовании комбинации ГГ (1500 мг/сут) и ХС (1200 мг/сут) в течение 4 мес. у 34 мужчин с ОА коленных суставов и болью в нижнем отделе спины наблюдалось значительное уменьшение боли в суставах [30]. В другом слепом плацебо-контролируемом исследовании комбинированной терапии ХС и ГГ у 93 больных с ОА коленных суставов выявлено значимое уменьшение симптомов по сравнению с таковым в контрольной группе через 4—6 мес. после начала лечения [31]. Комбинированная терапия ХС и ГГ у больных ОА коленных суставов (n=72) с умеренными рентгенологическими изменениями привела к статистически значимому снижению индекса Лекена через 6 мес. по сравнению с плацебо (р=0,04) [32].
В крупном двойном слепом плацебо-контролируемом исследовании D.O. Clegg и соавт. [33] установлено, что комбинация ГГ и ХС по анальгетическому действию превосходила плацебо у больных ОА с умеренной и выраженной болью: улучшение отмечено в 75 и 48,6% случаев соответственно (p<0,01). В дальнейшем в этом исследовании 572 пациента со II–III стадией ОА и шириной суставной щели ≥2 мм продолжили прием ГГ и ХС в тех же дозах в течение 24 мес. При этом у больных со II стадией эффективность терапии всеми исследуемыми препаратами (ГГ, ХС, ГГ + ХС или целекоксибом) была выше, чем в группе плацебо [34]. М.С. Hochberg и соавт. [35] изучили эффективность и безопасность комбинации ХС и ГГ (400 и 500 мг 3 раза в день) по сравнению с целекоксибом (200 мг 1 раз в день) у 606 пациентов с ОА коленного сустава в течение 6 мес. и указали на сопоставимое действие этих препаратов. Через 6 мес. ответ на терапию по критериям OMERACT–OARSI получен у 79,7% пациентов из группы комбинированной терапии и у 79,2% больных из группы целекоксиба. Авторы подтвердили анальгетическую и противовоспалительную эффективность комбинированного препарата ХС и ГГ. Влияние комбинации ХС + ГГ на прогрессирование ОА изучено в двух крупных исследованиях. В Канаде J. Martel-Pelletier и соавт. [36] с помощью высокочувствительной МРТ установили, что у больных, принимавших комбинацию ХС и ГГ, через 24 мес. потеря объема хряща была меньше, чем у пациентов, не получавших такого лечения. Авторы сделали вывод, что комбинация ХС и ГГ замедляет прогрессирование ОА, т. е. обладает структурно-модифицирующим эффектом, что было доказано при наблюдении за этими больными в течение последующих 6—8 лет. В другом рандомизированном двойном слепом плацебо-контролируемом исследовании эффективности ХС, ГЛ и их комбинации, продолжавшемся 2 года, также наблюдался структурно-модифицирующий эффект комбинации ГЛ и ХС в виде статистически значимого замедления сужения суставной щели коленного сустава, в то время как монокомпонентные препараты ГЛ и ХС такого действия не оказывали [37].
Комбинированная терапия ХС и ГЛ изучалась не только при ОА периферических суставов, но и при дегенеративных заболеваниях позвоночника. Имеются данные об эффективности ХС и ГС в лечении дегенеративных изменений в межпозвоночных дисках, подтвержденные при МРТ.
А.М. Лила и соавт. [38] оценивали эффективность комбинации ХС и ГГ (Терафлекс) у 60 больных с ОА коленных суставов и остеохондрозом позвоночника: 30 из них принимали Терафлекс по 1 таб. 2 раза в день и диклофенак в суточной дозе 75 мг, а остальные 30 — только диклофенак 75 мг/сут. У 40% пациентов первой группы и 26,7% второй имелись клинические и рентгенологические признаки сочетанной патологии — ОА и остеохондроза позвоночника. К 6-му месяцу наблюдения боль в коленных суставах снизилась на 71,9% у больных, получавших диклофенак + Терафлекс, и только на 45,7% у пациентов, использовавших только диклофенак (p<0,001). Авторы заключили, что Терафлекс обладает существенным симптом-модифицирующим действием. На фоне терапии также значительно уменьшилась выраженность боли в позвоночнике, причем данный эффект сохранялся на протяжении всего исследования. К концу 6-го месяца интенсивность боли снизилась на 83,3% в группе комбинированного лечения и на 56,7% в группе сравнения (p<0,05). Оценки эффективности терапии пациентами и врачами существенно не различались.
Исследование Л.И. Беневоленской и соавт. [39] было посвящено определению эффективности и безопасности комбинированной терапии ХС и ГГ (Терафлекс). Позже нами было проведено сравнительное исследование эффективности, безопасности, длительности последействия постоянного и интермиттирующего приема Терафлекса у пациентов с ОА коленных суставов в течение 12 мес. [40], показавшее сопоставимую эффективность обеих схем приема препарата по влиянию на боль, функцию суставов и длительность последействия. К концу приема Терафлекса более трети больных полностью отказались от сопутствующей терапии НПВП, что свидетельствует о наличии у этого препарата анальгетического и противовоспалительного действия. Уменьшение дозы или прекращение приема НПВП имеет существенное значение для безопасности терапии у пациентов с ОА и высокой коморбидностью, особенно старшего возраста. Кроме того, перерывы в приеме препарата обычно повышают комплаентность пациента и снижают затраты на лечение.
Данные промежуточного анализа постмаркетингового наблюдательного исследования, полученные через 16—24 нед. лечения Терафлексом, свидетельствуют о снижении частоты возникновения, интенсивности боли и других симптомов ОА, а также об увеличении функциональной активности и улучшении качества жизни пациентов с ОА коленного или тазобедренного суставов уже после первого курса терапии. Клинически значимое улучшение определялось по каждой из субшкал Шкалы оценки повреждения коленного сустава и исхода остеоартрита (Knee injury and Osteoarthritis Outcome Score, KOOS) или Шкалы оценки ограничений функций тазобедренного сустава и исхода остеоартрита (Hip injury and Osteoarthritis Outcome Score, HOOS) через 4—6 мес. после начала лечения. Большинство пациентов были удовлетворены результатами терапии. Частота нежелательных реакций была низкой, а их характер соответствовал известной информации о безопасности препарата [41].
В сентябре 2019 г. состоялся Экспертный совет по остеоартриту (ОА), в состав которого вошли представители ведущих российских и международных научных и образовательных медицинских организаций, признанные эксперты в области ревматологии и травматологии-ортопедии. Участники Экспертного совета обсудили последние рекомендации по лечению ОА. В рекомендациях ESCEO еще раз была подчеркнута необходимость комплексного немедикаментозного и медикаментозного лечения ОА с использованием SYSADOA — класса препаратов, которые положительно влияют на симптомы ОА и обладают доказанным болезнь-модифицирующим действием при длительном применении. ESCEO рекомендует включение этих препаратов (но только произведенных на основе качественных фармацевтических субстанций) в базисную терапию ОА. Терапевтическими дозами ГЛ и ХС являются ≥1500 и ≥800 мг/сут соответственно. Участники Экспертного совета пришли к выводу, что лечение ОА в реальной клинической практике должно быть основано на оценке состояния пациента, а также учете его потребностей и предпочтений и на современных доказательствах эффективности терапии.
Лечение больных ОА на основании принципов доказательной медицины предполагает комплексный подход и необходимость назначения SYSADOA, в том числе комбинированных препаратов ХС и ГЛ, в терапевтических дозах на ранних стадиях заболевания в качестве первого базисного средства [42].
В 2018 г. после проведения большого когортного исследования MILOS, в котором была выявлена ассоциация ОА с летальностью, FDA признала ОА серьезным заболеванием. В последнее время стали появляться эпидемиологические исследования, посвященные оценке влияния различных факторов (возраст, мультиморбидность, полипрагмазия и др.) на смертность при ОА. Еще в 2012 г. G.A. Bell и соавт. [43], анализируя летальность среди 77 510 жителей штата Вашингтон в возрасте от 50 до 76 лет с 2000 по 2008 г., обнаружили более низкую вероятность смерти при приеме ГЛ с/без ХС (отношение рисков, ОР 0,82; 95% ДИ 0,75—0,90) и при приеме ХС (ОР 0,86; 95% ДИ 0,78—0,96). В эпидемиологическом исследовании смертности среди лиц, постоянно принимающих ГЛ [44], в котором использовались данные британского биобанка, обнаружен более низкий риск развития сердечно-сосудистых заболеваний (ОР 0,85; 95% ДИ 0,80—0,90), а также смерти от сердечно-сосудистых заболеваний (ОР 0,78; 95% ДИ 0,70—0,87), ишемической болезни сердца (ОР 0,82; 95% ДИ 0,76—0,88) и инсульта (ОР 0,91; 95% ДИ 0,83–1,00). В американском исследовании, основанном на комбинированных данных программы Национального обследования здоровья и питания (NHANES) за 1999—2010 гг. и объединенных данных анкетирования населения с учетом сведений о смертности, к концу 2015 г. было проанкетировано 16 686 участников, из которых 658 (3,94%) принимали ГЛ/ХС в течение года и более. Во время наблюдения (медиана 107 мес) зафиксировано 3366 (20,17%) смертей, в том числе 674 (20,02%) вследствие сердечно-сосудистых заболеваний. Авторы заключили, что регулярный прием ГЛ/ХС, по-видимому, в значительной степени ассоциируется со снижением общей и сердечно-сосудистой смертности (уменьшение вероятности на 27 и 58% соответственно) [45].
Таким образом, представленные данные клинических исследований эффективности ГЛ, ХС и их комбинации у пациентов с ОА свидетельствуют о наличии у этих препаратов симптоматического и структурно-модифицирующего действия. В соответствии с рекомендациями ESCEO, Федеральными клиническими рекомендациями по лечению ОА и Клиническими рекомендациями консенсуса экспертов Российской Федерации медикаментозное лечение ОА необходимо начинать с SYSADOA уже при первых симптомах заболевания. Такая терапия должна быть длительной с учетом ее высокой безопасности, а также возможного снижения риска развития сердечно-сосудистых катастроф.
Литература
1. Kovari E, Kaposi A, Bekes G, et al. Comorbidity clusters in generalized osteoarthritis among female patients: A crosssectional Semin Arthritis Rheum. 2020 Apr;50(2):183-91. doi: 10.1016/j.semarthrit. 2019.09.001. Epub 2019 Sep 9.
2. Балабанова РМ, Дубинина ТВ, Демина АБ, Кричевская ОА. Заболеваемость болезнями костно-мышечной системы в Российской Федерации за 2015–2016 гг. Научно-практическая ревматология. 2018;56(1):15-21. [Balabanova RM, Dubinina TV, Demina AB, Krichevskaya OA. The incidence of diseases of the musculoskeletal system in the Russian Federation for 2015–2016. Nauchno-prakticheskaya revmatologiya. 2018;56(1):15-21. (In Russ.)].
3. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018 Nov 10;392(10159):1789-858. doi: 1016/S0140-6736(18)32279-7. Epub 2018 Nov 8.
4. Felson DT, Lawrence RC, Dieppe PA, et al. Osteoarthritis: new insights. Part 1: the disease and its risk Ann Intern Med. 2000 Oct 17;133(8):635-46. doi: 10.7326/0003-4819-133-8-200010170-00016.
5. Bijlsma JW, Berenbaum F, Lafeber FP. Osteoarthritis: an update with relevance for clinical practice. Lancet. 2011 Jun 18; 377(9783):2115-26. doi: 10.1016/S01406736(11)60243-2.
6. Wallace IJ, Worthington S, Felson DT, et Knee osteoarthritis has doubled in prevalence since the mid-20th century. Proc Natl Acad Sci U S A. 2017 Aug 29;114(35):9332-36. doi: 10.1073/pnas. Epub 2017 Aug 14.
7. Zheng H, Chen Body mass index and risk of knee osteoarthritis: systematic review and meta-analysis of prospective studies. BMJ Open. 2015 Dec 11;5(12):e007568. doi: 10.1136/bmjopen-2014-007568.
8. Fu Y, Griffin TM. Obesity, Osteoarthritis And Aging: The Biomechanical Links. Mechanobiology Of Obesity And Related Springer International Publishing; 2015. P. 181–201.
9. Wang H, Cheng Y, Shao D, et al. Metabolic Syndrome Increases the Risk for Knee Osteoarthritis: A Meta-Analysis. Evid Based Complement Alternat 2016;2016: 7242478. doi: 10.1155/2016/7242478. Epub 2016 Oct 11.
10. Yoshimura N, Muraki S, Oka H, et al. Accumulation Of Metabolic Risk Factors Such As Overweight, Hypertension, Dyslipidaemia, And Impaired Glucose Tolerance Raises The Risk Of Occurrence And Progression Of Knee Osteoarthritis: A 3-Year Follow-Up Of The Road Study. Osteoarthritis Cartilage. 2012 Nov;20(11): 1217-26. doi: 1016/j.joca.2012.06.006. Epub 2012 Jul 14.
11. Bruyere O, Cooper C, Pelletier JP, et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin Arthritis 2014 Dec;44(3):253-63. doi: 10.1016/j.semarthrit.2014.05.014. Epub 2014 May 14.
12. Bruyere O, Cooper C, Pelletier JP, et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis – From evidence-based medicine to the real-life setting. Semin Arthritis Rheum. 2016 Feb;45(4 Suppl):S3-11. doi: 10.1016/j.semarthrit.2015.11.010. Epub 2015 Dec 2.
13. Arden NK, Perry TA, Bannuru RR, et al. Non-surgical management of knee osteoarthritis: comparison of ESCEO and OARSI 2019 Nat Rev Rheumatol. 2021 Jan;17(1):59-66. doi: 10.1038/s41584020-00523-9. Epub 2020 Oct 28.
14. Ronca F, Palmieri L, Panicucci P, Ronca G. Anti-inflammatory activity of chondroitin sulfate. Osteoarthritis Cartilage. 1998 May;6 Suppl A:14-21. doi: 10.1016/ s1063-4584(98)80006-x.
15. Алексеева ЛИ, Беневоленская ЛИ, Насонов ЕЛ и др. Структум (хондроитин сульфат) – новое средство для лечения остеоартроза (ОА). Терапевтический Архив. 1999;(5):51-3. [Alekseeva LI, Benevolenskaya LI, Nasonov EL, et al. Structum (chondroitin sulfate) – a new treatment for osteoarthritis (OA). Terapevticheskii Arkhiv. 1999;(5):51-3. (In Russ.)].
16. Singh JA, Noorbaloochi S, MacDonald R, Maxwell LJ. Chondroitin for osteoarthritis. Cochrane Database Syst 2015 Jan 28; 1:CD005614. doi: 10.1002/14651858. CD005614.pub2.
17. Michel BA, Stucki G, Frey D, et Chondroitins 4 and 6 sulfate in osteoarthritis of the knee: a randomized, controlled trial. Arthritis Rheum. 2005 Mar;52(3):779-86. doi: 10.1002/art.20867.
18. Kahan A, Uebelhart D, De Vathaire F, et al. Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a twoyear, randomized, double-blind, placebocontrolled trial. Arthritis Rheum. 2009 Feb; 60(2):524-33. doi: 10.1002/art.24255.
19. Hochberg Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta-analysis of randomized placebo-controlled trials of 2-year duration. Osteoarthritis Cartilage. 2010 Jun;18 Suppl 1:S28-31. doi: 10.1016/j.joca.2010.02.016. Epub 2010 Apr 27.
20. Railhac JJ, Zaim M, Saurel AS, et Effect of 12 months treatment with chondroitin sulfate on cartilage volume in knee osteoarthritis patients: a randomized, doubleblind, placebo-controlled pilot study using MRI. Clin Rheumatol. 2012 Sep;31(9):1347-57. doi: 10.1007/s10067-012-2022-4. Epub 2012 Jun 23.
21. Verbruggen G, Goemaere S, Veys EM. Systems to assess the progression of finger joint osteoarthritis and the effects of disease modifying osteoarthritis drugs. Clin 2002 Jun;21(3):231-43. doi: 10.1007/s10067-002-8290-7.
22. Gabay C, Medinger-Sadowski C, Gascon D, et al. Symptomatic effects of chondroitin 4 and chondroitin 6 sulfate on hand osteoarthritis: a randomized, double-blind, placebo-controlled clinical trial at a single Arthritis Rheum. 2011 Nov;63(11): 3383-91. doi: 10.1002/art.30574.
23. Du Souich Absorption, distribution and mechanism of action of SYSADOAS. Pharmacol Ther. 2014 Jun;142(3):362-74. doi: 10.1016/j.pharmthera.2014.01.002. Epub 2014 Jan 21.
24. Towheed TE, Maxwell L, Anastassiades TP, et Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev. 2005 Apr 18;(2):CD002946. doi: 10.1002/14651858.CD002946.pub2.
25. Eriksen P, Bartels EM, Altman RD, et al. Risk of bias and brand explain the observed inconsistency in trials on glucosamine for symptomatic relief of osteoarthritis: a metaanalysis of placebo-controlled Arthritis Care Res (Hoboken). 2014 Dec;66(12):1844-55. doi: 10.1002/acr.22376.
26. Gregori D, Giacovelli G, Minto C, et Association of Pharmacological Treatments With Long-term Pain Control in Patients With Knee Osteoarthritis: A Systematic Review and Meta-analysis. JAMA. 2018 Dec 25;320(24):2564-79. doi: 10.1001/jama. 2018.19319.
27. Provenza JR, Shinjo SK, Silva JM, et al. Combined glucosamine and chondroitin sulfate, once or three times daily, provides clinically relevant analgesia in knee Clin Rheumatol. 2015 Aug;34(8):1455-62. doi: 10.1007/s10067-014-2757-1. Epub 2014 Aug 3.
28. Beaudart C, Lengele L, Leclercq V, et Symptomatic Efficacy of Pharmacological Treatments for Knee Osteoarthritis: A Systematic Review and a Network Meta-Analysis with a 6-Month Time Horizon. Drugs. 2020 Dec;80(18):1947-59. doi: 10.1007/s40265020-01423-8.
29. Damlar I, Esen E, Tatli Effects of glucosamine-chondroitin combination on synovial fluid IL-1b, IL-6, TNF-a and PGE2 levels in internal derangements of temporomandibular joint. Med Oral Patol Oral Cir Bucal. 2015 May 1;20(3):e278-83. doi: 10.4317/medoral. 20242.
30. Leffler CT, Philippi AF, Leffler SG, et Glucosamine, chondroitin, and manganese ascorbate for degenerative joint disease of the knee or low back: a randomized, doubleblind, placebo-controlled pilot study. Mil Med. 1999 Feb;164(2):85-91.
31. 66th Ann Meeting of 1999. P.180.
32. Das AK Jr, Hammad TA. Efficacy of a combination of FCHG49 glucosamine hydrochloride, TRH122 low molecular weight sodium chondroitin sulfate and manganese ascorbate in the management of knee Osteoarthritis Cartilage. 2000 Sep; 8(5):343-50. doi: 10.1053/joca.1999.0308.
33. Clegg DO, Reda DJ, Harris CL, et Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N Engl J Med. 2006 Feb 23; 354(8):795-808. doi: 10.1056/NEJM oa052771.
34. Sawitzke AD, Shi H, Finco MF, et The effect of glucosamine and/or chondroitin sulfate on the progression of knee osteoarthritis: a report from the glucosamine/chondroitin arthritis intervention trial. Arthritis Rheum. 2008 Oct;58(10):3183-91. doi: 10.1002/art.23973.
35. Hochberg MC, Martel-Pelletier J, Monfort J. SAT0427 Multicentric Osteoarthritis Intervention Study with Sysadoa (MOVES): Effects of Combined Glucosamine Hydrochloride and Chondroitin Sulfate VS Celecoxib for Painful Knee Ann Rheum Dis. 2014 Jun; 73(Suppl 2):749. doi: 10.1136/annrheumdis2014-eular.49503.
36. Martel-Pelletier J, Roubille C, Abram F, et First-line analysis of the effects of treatment on progression of structural changes in knee osteoarthritis over 24 months: data from the osteoarthritis initiative progression cohort. Ann Rheum Dis. 2015 Mar;74(3):54756. doi: 10.1136/annrheumdis-2013-203906. Epub 2013 Dec 13.
37. Fransen M, Agaliotis M, Nairn L, et LEGS study collaborative group. Glucosamine and chondroitin for knee osteoarthritis: a double-blind randomised placebo-controlled clinical trial evaluating single and combination regimens. Ann Rheum Dis. 2015 May;74(5):851-8. doi: 10.1136/ annrheumdis-2013-203954. Epub 2014 Jan 6.
38. Лила АМ. Терафлекс в комплексной терапии остеоартроза коленных суставов и остеохондроза позвоночника (результаты клинического исследования). Русский медицинский журнал. 2005;(24):1618-22. [Lila AM. Teraflex in the complex therapy of knee osteoarthritis and spinal osteochondrosis (results of a clinical study). Russkii meditsinskii 2005;(24):1618-22. (In Russ.)].
39. Беневоленская ЛИ, Алексеева ЛИ, Зайцева ЕМ. Эффективность препарата терафлекс у больных остеоартрозом коленных и тазобедренных суставов (открытое рандомизированное исследование). Русский медицинский журнал. 2005; (8):525-7.[Benevolenskaya LI, Alekseeva LI, Zaitseva EM. Efficacy of teraflex in patients with osteoarthritis of the knee and hip joints (open randomized study). Russkii meditsinskii zhurnal. 2005;(8):525-7. (In Russ.)].
40. Алексеева ЛИ, Кашеварова НГ, Шарапова ЕП и др. Сравнение постоянного и интермиттирующего лечения больных остеоартрозом коленных суставов комбинированным препаратом «Терафлекс». Научно-практическая ревматология. 2008; (3);68-72. [Alekseeva LI, Kashevarova NG, Sharapova EP, et al. Comparison of continuous and intermittent treatment of patients with osteoarthritis of the knee joints with the combined drug Teraflex. Nauchno-prakticheskaya revmatologiya. 2008;(3);68-72. (In Russ.)].
41. Telyshev K, Alekseeva L, Lila A, et AB0885 Effectiveness and safety of glucosamine and chondroitin combination in patients with knee and hip osteoarthritis: interim analysis results of an observational study. Ann Rheum Dis. 2020;79:1747.
42. Лила АМ, Алексеева ЛИ, Бабаева АР и др. Возможности фармакологического лечения остеоартрита: фокус на симптоматические медленно действующие препараты (SYSADOA) и индивидуальные особенности пациента. Резолюция международного совещания экспертов. Современная ревматология. 2019;13(4):143-7. [Lila AM, Alekseeva LI, Babaeva AR, et al. Vozmozhnosti farmakologicheskogo lecheniya osteoartrita: fokus na simptomaticheskie medlenno deistvuyushchie preparaty (SYSADOA) i individual'nye osobennosti patsienta. Rezolyutsiya mezhdunarodnogo soveshchaniya ekspertov. Sovremennaya revmatologiya. 2019;13(4):143-7. (In Russ.)].
43. Bell GA, Kantor ED, Lampe JW et al. Use of glucosamine and chondroitin in relation to Eur J Epidemiol. 2012 Aug; 27(8):593-603. doi: 10.1007/s10654-0129714-6. Epub 2012 Jul 25.
44. Ma H, Li X, Sun D, Zhou T, et al. Association of habitual glucosamine use with risk of cardiovascular disease: prospective study in UK BMJ. 2019 May 14;365:l1628. doi: 10.1136/bmj.l1628.
45. King DE, Xiang J. Glucosamine/ Chondroitin and Mortality in a US NHANES Cohort. J Am Board Fam Med. Nov-Dec 2020;33(6):842-7. doi: 3122/ jabfm.2020.06.200110.
Поступила/отрецензирована/принята к печати Received/Reviewed/Accepted 13.02.2021/27.03.2021/30.03.2021.
Заявление о конфликте интересов/Conflict of Interest Statement
Статья спонсируется компанией «Байер». Спонсор участвовал в разработке проекта исследования и поддержке исследовательской программы, а также принятии решения о представлении статьи для публикации. Конфликт интересов не повлиял на результаты исследования.
Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать. Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи была одобрена всеми авторами.
This article has been supported by Вayer. The sponsor has participated in the development of the investigation project and supported the investigation program, as well as in the decision to submit the article for publication. The conflict of interest has not affected the results of the investigation.
The authors are solely responsible for submitting the final version of the manuscript for publication. All the authors have participated in developing the concept of the article and in writing the manuscript. The final version of the manuscript has been approved by all the authors.
Алексеева Л.И. https://orcid.org/0000-0001-7017-0898.
Лила А.М. https://orcid.org/0000-0002-6068-3080.
Материал ранее был опубликован в журнале «Современная ревматология» 2021; 15 (2): 112–119.
Материал партнера: Bayer















