FDA одобрило первую мРНК-вакцину против респираторно-синцитиального вируса
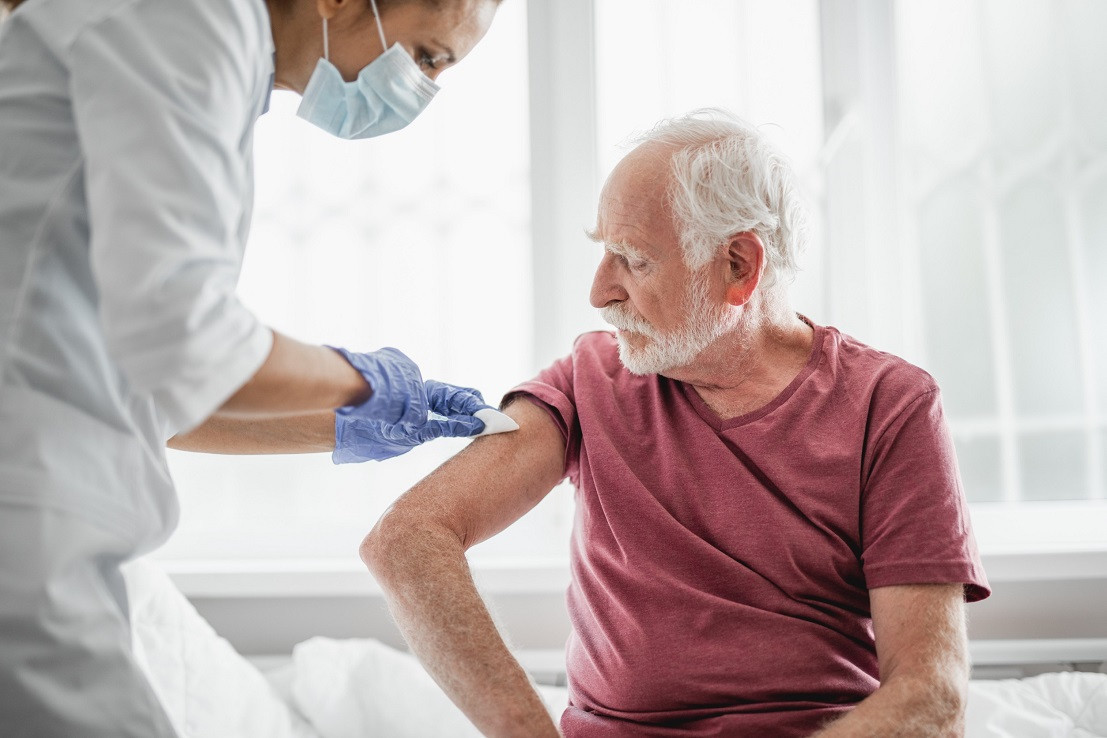
Управление по контролю качества пищевых продуктов и лекарственных средств (FDA) США одобрило вакцину компании Moderna против респираторно-синцитиального вируса (РСВ). Об этом говорится в пресс-релизе разработчика препарата, сообщил «Фармацевтический вестник».
Препарат получил название mRESVIA (mRNA-1345) и предназначен для профилактики инфекций нижних дыхательных путей, вызванных РСВ, у людей в возрасте от 60 лет. Он разработан на основе платформы матричной РНК (мРНК) по аналогии с вакциной от COVID-19, которую Moderna представила в 2020 году.
Это третья вакцина, одобренная FDA для профилактики заболеваний нижних дыхательных путей, вызванных РСВ. Первой стала Arexvy от компании GlaxoSmithKline (GSK), второй — Abrysvo от Pfizer. В то же время mRESVIA — первая вакцина от РСВ, разработанная при использовании технологии мРНК.
Регулятор одобрил препарат на основании данных, полученных в ходе клинических испытаний на фазе III c участием 37 000 человек из 22 стран. Предварительные результаты показали, что вакцина эффективна на 84% в предотвращении РСВ. Дальнейший анализ выявил, что ее эффективность составляет 79%.
Продукт Moderna выпускается в виде предварительно заполненных шприцев, которые вводятся единожды. Вакцина не имеет серьезных побочных эффектов. Чаще всего пациенты после прививки жаловались на боль в месте укола, слабость и головные боли.
|
Респираторно-синцитиальный вирус, вызывающий инфекции дыхательных путей, передается воздушно-капельным путем. Чаще всего им заражаются в холодное время года. Он может приводить к развитию бронхиолита и пневмонии у детей в первые два года жизни. У взрослых и пожилых людей, особенно с ослабленным иммунитетом, РСВ может также провоцировать тяжелые респираторные заболевания, в том числе бронхопневмонию. Ежегодно РСВ-инфекции становятся причиной госпитализации от 60 тыс. до 160 тыс. пожилых пациентов в США. От 6 тыс. до 10 тыс. человек умирают из-за вируса. |















Нет комментариев
Комментариев: