Самые важные новости сферы здравоохранения теперь и в нашем Telegram-канале @medpharm.
Интеллектуальные траты: на что ориентироваться регионам при закупке «умных» медизделий

Как внедряются МИ с ИИ
В прошлом году 84 российских субъекта закупили 106 МИ с ИИ. При этом 14 регионов приобрели сразу два и более таких медизделия. Поскольку значительная часть закупок пришлась на вторую половину года, эксплуатацию успели начать лишь 58 регионов, проинформировала на научно-практической конференции ITM-AI в феврале замдиректора Департамента цифрового развития и информационных технологий Минздрава Олия Артемова.
К концу этого года в регионах должно быть внедрено в практическое здравоохранение уже по три решения с ИИ. Приобретать их будут на условиях софинансирования, взяв федеральную долю из средств, поступающих по линии проекта «Создание единого цифрового контура в здравоохранении на основе ЕГИСЗ», суммарный бюджет которого в 2019–2024 годах равен 113,8 млрд руб. Так как эти деньги не окрашены, субъект сам решает, сколько из них направить именно на МИ с ИИ.
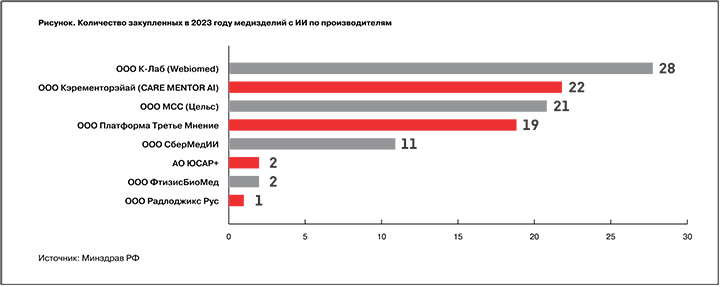
Чтобы не допустить ошибок прошлого года, необходимо обратить особое внимание на то, чтобы все закупаемые сервисы были зарегистрированы Росздравнадзором, имели статус медизделия и были внесены в Реестр отечественного программного обеспечения (ПО), подчеркнула Артемова. Согласно рекомендациям Минздрава (письмо №18-6/И/2-471 от 16.01.2024), за счет средств федерального бюджета необходимо приобретать бессрочную неисключительную лицензию, а также работы по внедрению с поддержкой не менее чем на 12 месяцев. Использование медицинских данных, предоставляемых для работы МИ с ИИ, не допускается для каких-либо иных целей, кроме обработки медизделием, дообучения, донастройки или корректировки его работы. Регионам рекомендовано предусмотреть формирование отчета, содержащего статистику применения МИ с ИИ: обработанные исследования или электронные медкарты (ЭМК), технические ошибки, неблагоприятные события.
Как меняется отношение к технологии
«Я — медик с 22-летним стажем, и совсем недавно, лет, наверное, пять назад, нам еле-еле удавалось вставить в программы медицинских конгрессов хотя бы один доклад по ИИ, — рассказала медицинский директор ООО «Телемедицинские информационные системы» Екатерина Кобякова. — В институте онкологии им. Н.Н. Блохина я как-то спорила с нашим именитым академиком по поводу включения доклада по ИИ, а он не давал своего разрешения, говоря, что это — мракобесие. Картина меняется. Это очень приятно. Еще приятнее, что на конференции присутствуют клиницисты, которые могут доложить о своих результатах внедрения ИИ». На конференции были представлены как МИ с ИИ, уже прошедшие регистрацию в Росздравнадзоре (всего по состоянию на 1 февраля таких насчитывается 26, из них российских 20) или готовящиеся ее проходить, а также первые результаты внедрения решений на базе технологии ИИ, систем поддержки принятия врачебных решений (СППВР) в клиническую практику в самых разных сферах медицины: от калькуляторов для расчета дозирования витамина D и сервисов, позволяющих прогнозировать пребывание пациента в стационаре, исходя из его персональных характеристик, а не просто клинических рекомендаций, до разнообразных цифровых помощников на основе компьютерного зрения.
Каждая презентация сопровождалась множеством вопросов со стороны экспертов, которые явно указывали на то, что требования к МИ с ИИ растут. Во-первых, многие разработчики концентрируются на одной, подчас достаточно узкой задаче, отметила главный внештатный специалист по информационным системам в здравоохранении Минздрава, директор Института цифровой трансформации медицины Татьяна Зарубина. А если в зону ответственности врача входит клиническое решение десятков таких задач, если у него на приеме коморбидный пациент, то неизбежно возникают вопросы интеграции в единую медицинскую информационную систему, интероперабельности и масштабирования, подчеркнула эксперт.
Во-вторых, закупаемый на бюджетные средства сервис должен приносить измеримый медико-экономический эффект, быть в состоянии выполнять бизнес-процесс «лучше, чем сейчас»: не хуже человека, но при меньших временных, денежных, инфраструктурных или прочих затратах, продолжил замдиректора по реализации федеральных проектов НМИЦ онкологии им. Н.Н. Блохина, руководитель первого в стране исследовательского центра в сфере искусственного интеллекта в здравоохранении Тигран Геворкян. По его словам, когда разработчик идет на регистрацию ПО в качестве медизделия, желательно, чтобы он предоставлял данные рандомизированного исследования, по аналогии с тем, как это делают фармпроизводители при регистрации препаратов.
|
Согласно «дорожной карте» Минздрава, основные направления работы в сфере внедрения ИИ:
|
«Взяли больницу одного города: грубо говоря, половину пациентов лечили с применением цифрового сервиса, вторую — без него. А потом сравнили результаты и убедились, что в первом случае получены лучшие показатели по таким-то параметрам», — предложил Геворкян.
«Рандомизированные исследования мы не проводим не потому, что мы какие-то злодеи, а потому что это крайне дорого», — парировал менеджер по развитию бизнеса IT-компании «ТехЛАБ» Владимир Рудченко.
Медицине нужны решения, которые не просто соответствуют всем характеристикам регистрационного удостоверения, а которые действительно востребованы, отреагировал Геворкян. «Если цифровой сервис будет способствовать раннему выявлению заболевания, которое сегодня социально не значимо, или расходы на внедрение не сопоставимы с получаемым эффектом, то это должно учитываться, — продолжил эксперт. — Сейчас все только начинается, достаточно хаотично, но всем все нравится, все покупают эти решения «на хайпе». Но как только начнется использование в боевых условиях, все поменяется».
Есть ли жизнь после внедрения
По мнению Геворкяна, разработчикам стоит приготовиться и к перегибам, к тому, что врачи будут просить дать им «больше, чем реально надо».
«Я хочу обратиться к медицинскому сообществу: ну не будет вам искусственный интеллект с первого дня нажатием одной кнопки выставлять диагноз», — подчеркнул глава исследовательского центра по ИИ.
Крайне важно, чтобы после поставки продукта в медорганизацию разработчик оставался в контакте с заказчиком, получал обратную связь и мог осуществлять пострегистрационный мониторинг, в том числе по мере необходимости исправлять ошибки и дообучать систему, уверен технический директор компании «Медицинские скрининг-системы» (искусственный интеллект для анализа медицинских изображений «Цельс») Евгений Никитин. Сейчас разработчики нередко не имеют ни малейшего представления, как работают их решения в реальных условиях.
«Проблема мониторинга в регионах и у нас, и у наших конкурентов связана с доступом к данным заказчиков, — объяснил Никитин. — Где-то у нас есть доступ к самим исследованиям (анонимизированным), где-то — где локально развернуто, стоит в каком-то доме, закрытом на замок, у нас вообще нет доступа. Там мы вообще не знаем, что происходит, то есть система работает как «черный ящик» «в квадрате»».
«Мы будем инициировать, чтобы на этапе до регистрации разработчики публиковали результаты клинических испытаний так же, как сегодня происходит при регистрации фармпродукции, других сложных медизделий, — анонсировал Геворкян. — Есть идея разработать подход и программный продукт, благодаря которому после выдачи РУ Росздравнадзор сможет осуществлять постоянный пострегистрационный мониторинг МИ с ИИ, чтобы периодически его валидировать и определять соответствие функциональности регдосье. Мы доведем ее до сведения регулятора».
Персоны





Нет комментариев
Комментариев: