В России зарегистрировали первый препарат для CAR-T-терапии
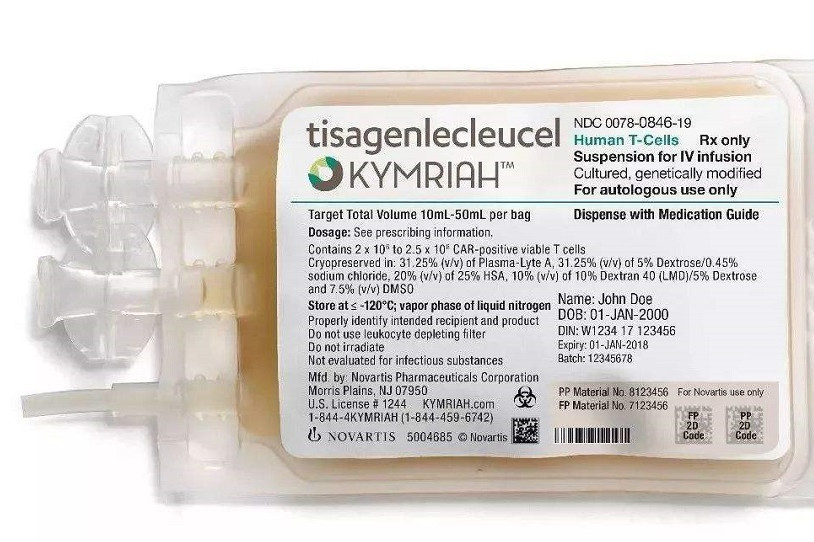
Минздрав зарегистрировал биологический, высокотехнологичный лекарственный препарат «Кимрая» (Kymriah, МНН тисагенлеклейцел 1,2 клетка). Новая терапия показана для лечения острого лимфобластного лейкоза у пациентов от трех до 25 лет, а также рецидивирующей или рефрактерной диффузной В-крупноклеточной лимфомы у взрослых пациентов, сообщил «Фармацевтический вестник».
Препарат получил условную регистрацию в соответствии с требованиями ЕАЭС, уточнили в Минздраве. То есть ведомство будет ежегодно пересматривать соотношение риска и пользы «Кимраи», пока его клинические исследования не закончены и не представлены окончательные выводы о его эффективности и безопасности. Проведение КИ препарата в России не потребуется.
«Кимрая» — препарат генной терапии. Каждая его доза представляет собой индивидуальное лечение с использованием собственных Т-клеток отдельного пациента. Т-клетки пациента собираются и генетически модифицируются, что позволяет им распознавать и уничтожать CD19-положительные В-клетки. После того как Т-клетки модифицируются, они вводятся обратно пациенту, чтобы убить раковые клетки, говорится на сайте Управления по контролю за качеством пищевых продуктов и лекарственных средств (FDA) США.
Там перечислены возможные серьезные побочные эффекты при лечении «Кимраей». К ним относится синдром высвобождения цитокинов, который служит системным ответом на активацию CAR-T-клеток, вызывающих высокую температуру и гриппоподобные симптомы или неврологические нарушения. При терапии лекарством возможны серьезные инфекции, гипотония, повреждение почек, лихорадка и гипоксия.
| Kymriah — первый препарат CAR-T-терапии в США. В 2017 году препарат был одобрен FDA по показанию «острый лимфобластный лейкоз», в 2018 году — по B-крупноклеточной лимфоме, а в 2022-м — для взрослых пациентов с рецидивирующей или рефрактерной фолликулярной лимфомой. Стоимость одного курса Kymriah оценивается в 475 тыс. долл. (около 39 млн руб.). |















Нет комментариев
Комментариев: