Безрецептурный напроксен в ревматологической практике: область применения и терапевтические преимущества
Каратеев А.Е.
Резюме:Безрецептурные нестероидные противовоспалительные препараты (НПВП) – фармакологические средства, содержащие относительно низкую дозу действующего вещества и предназначенные для кратковременного приема (до 3‒5 дней). Эти лекарства представляются удобным и эффективным инструментом контроля скелетно-мышечной боли во многих клинических ситуациях в ревматологической практике. Безрецептурный напроксен 275 мг, обладающий доказанной анальгетической эффективностью, длительностью действия (12‒15 час. после однократного приема) и благоприятным профилем безопасности, может с успехом использоваться для терапии обострений остеоартрита, кратковременных эпизодов боли при стабильном течении аутоиммунных воспалительных ревматических заболеваний, при острой неспецифической боли в спине и в дебюте лечения патологии околосуставных мягких тканей. Этот препарат, в соответствии с национальными рекомендациями по использованию НПВП, может назначаться на короткое время при проведении анальгетической терапии у пациентов с высоким риском кардиоваскулярных осложнений. Он представляет особую ценность для амбулаторной практики, поскольку может свободно приобретаться и использоваться пациентами в соответствии с принципами «ответственного самолечения». |
Ключевые слова:НПВП, напроксен, напроксен натрия, «Тералив 275», эффективность, безопасность, ревматические заболевания. |
Возникновение болевых ощущений при РЗ обусловлено их патогенезом и отражает в первую очередь процесс воспаления, вызванного аутоиммунными, метаболическими или дегенеративными нарушениями. Воспалительная реакция, при которой происходит активация и хемотаксис макрофагов, клеток лейкоцитарного и лимфоцитарного ряда, каскадная продукция цитокинов, хемокинов и факторов роста, синтез медиаторов воспаления, сопровождается сенситизацией периферических и центральных структур ноцицептивной системы, а также прямым возбуждением болевых рецепторов, которые широко представлены в синовиальной оболочке, надкостнице, связках и мышцах [2,3].
Однако боль – субъективное ощущение, интенсивность которого определяется не только выраженностью воспаления и тяжестью повреждения ткани, но и длительностью страданий, воспитанием, психологическим статусом, функциональными нарушениями, социальными проблемами и др. [4,5]. Поэтому переживание боли и оценка ее выраженности могут быть примерно одинаковыми как у пациентов с ревматоидным артритом (РА), для которого типично активное системное воспаление и клиника полиартрита, так и пациентов с остеоартритом (ОА), при котором воспалительная реакция имеет локальный, низкоинтенсивный характер, а поражение суставов проявляется моно- или олигоартритом. В этом плане весьма показательна работа T. Pincus и соавт. [6], которые сравнили субъективную оценку боли и функциональных нарушений у пациентов с ОА и РА по данным 8 исследований, проведенных в Европе и США. Медиана выраженности боли (по шкале 0‒10) составляла для РА от 4,3 до 4,7, для ОА – от 4,3 до 6,1; медиана значения HAQ составила для РА 1,7–3,2, для ОА – 1,9–2,7. Использование комплексного индекса активности RAPID 3 (routine assessment of patient index data) показало примерно равные значения для РА (средние значения от 6,2 до 15,6) и ОА (средние значения от 10,3 до 16,8). Как видно, по всем оцениваемым параметрам выраженность боли и функциональных нарушений при ОА отнюдь не меньше в сравнении с РА.
Применение анальгетиков при РЗ не теряет своей актуальности, несмотря на революционные достижения в лечении аутоиммунных воспалительных заболеваний, связанные с широким использованием в клинической практике генно-инженерных биологических препаратов (ГИБП) и таргетных синтетических базисных противовоспалительных препаратов (ингибиторы JAK). Даже эффективное подавление иммунного воспаления и достижение клинико-лабораторной ремиссии не обеспечивают полное устранение боли и связанных с ней психологических проблем, таких как депрессия и тревожность. С одной стороны, это определяется сложным, многоплановым патогенезом хронической боли при РЗ, включающем механизмы центральной сенситизации и нейропластические процессы. С другой – с функциональными нарушениями и дегенеративными процессами (фиброз, неоангиогенез, гетеротопическая оссификация), которые развиваются вследствие аутоиммунной агрессии и приводят к формированию «вторичного ОА» и стойким биомеханическим нарушениям [4,5,7].
Так, K. Michaud и соавт. [8] представили анализ 48 исследований, в которых оценивалось состояние больных РА, у которых на фоне активной терапии удалось добиться ремиссии или низкой активности заболевания. В большинстве работ отмечалось сохранение у этих пациентов «резидуальных» симптомов, снижающих качество жизни и вызывающих серьезное беспокойство пациентов. В 34 исследованиях было отмечено сохранение функциональных нарушений, в 18 – наличие боли и припухлости отдельных суставов, в 17 – сохранение боли, в 15 – неудовлетворительная оценка самочувствия, в 14 – повышенная утомляемость.
Хорошей иллюстрацией данного положения является недавно опубликованная работа французских ученых P. Vergne‐Salle и соавт. [9], которые оценили частоту боли у 295 больных РА, 83% из них получали ГИБП. Из данной когорты 38,7% пациентов находились в состоянии ремиссии (DAS28 ≤ 2,6), еще 15,4% имели низкую активность РА (DAS28 ≤3,2). У этих 156 пациентов, несмотря на очевидный успех терапии РА, отмечалось сохранение боли. Средняя выраженность болевых ощущений составляла 21,8±21,3, средняя интенсивность наиболее выраженной боли за последние 8 дней ‒ 29,1±27,5 мм ВАШ; ее интенсивность достоверно повышалась при ходьбе и особенно при работе. У 29,7% больных с низкой активностью или ремиссией РА отмечались признаки умеренной или выраженной депрессии.
Очевидно, что существенная часть больных РА вынуждена регулярно использовать обезболивающие препараты. Это показывает, в частности, исследование A. Steffen и соавт. [10], которые проанализировали использование различных препаратов у 54 896 больных РА по данным германского национального регистра. В данной когорте 64% пациентов принимали нестероидные противовоспалительные препараты (НПВП) в течение первого года и около 40% ‒ к третьему году лечения РА.
Еще выше потребность в анальгетиках при ОА – наиболее распространенном прогрессирующем заболевании суставов, характеризующимся хронической болью, при котором до настоящего времени отсутствует общепризнанная «базисная» патогенетическая терапия. Конечно, в качестве последней могут рассматриваться медленнодействующие симптоматические средства, МДСС (SYSADOA), их длительное применение позволяет уменьшить симптомы ОА и замедлить прогрессирование структурных изменений суставов. Однако эффект МДСС развивается не сразу и не всегда позволяет контролировать обострения заболевания. Поэтому при ОА так широко используются НПВП [1,3,11].
Это показывает работа М. Akazawa и соавт. [12], оценивших применение обезболивающих средств у 118 996 пациентов с ОА за период с 2013 по 2017 год по данным японского национального регистра. Примерно 90% из них были назначены НПВП.
С. Zeng и соавт. [13] провели анализ лекарственной терапии у 125 696 британских больных ОА за период с 2000 по 2016 год. Согласно полученным данным, 44% больных получали активную анальгетическую терапию – НПВП (перорально или локально), парацетамол или опиоиды.
Наиболее популярным средством для лечения боли, используемым в ревматологической практике, являются НПВП. Они удобны, доступны и обладают хорошим анальгетическим и противовоспалительным потенциалом, который позволяет успешно контролировать основные симптомы РЗ. Однако НПВП способны вызывать серьезные нежелательные реакции (НР), в основном со стороны желудочно-кишечного тракта и сердечно-сосудистой системы (ССС), что требует осторожного и взвешенного использования этого класса анальгетиков у лиц, имеющих серьезные коморбидные заболевания и факторы риска лекарственных осложнений [14‒18].
Одним из основных методов снижения риска НР, связанных с НПВП, может считаться использование последних в относительно низких дозах и в течение короткого времени [17,18]. Хорошо известно, что при длительном применении НПВП частота осложнений закономерно возрастает. Это было показано, в частности, в недавно опубликованном исследовании М. Bally и соавт. [19], которые оценили риск развития инфаркта миокарда (ИМ) у больных, принимавших НПВП, в зависимости от длительности использования этих препаратов. Исследуемую группу составили 21 256 пациентов, перенесших данное осложнение, 233 816 – соответствующий по полу и возрасту контроль. Практически все НПВП демонстрировали четкую зависимость между развитием ИМ и сроком их приема, при этом минимальным риск оставался только в первые 7 дней.
В реальной практике ревматолога достаточно часто возникают ситуации, когда контроль боли требует использования анальгетиков в течение лишь короткого времени. Например, выше были представлены работы, в которых отмечалось появление боли у пациентов с РА, получавших адекватную терапию БПВП и находящихся в состоянии ремиссии или стабильно низкой активности [8,9]. Фактором, провоцирующим появление этих болей, может быть физическая нагрузка (нередко обычная бытовая), которая становится серьезным «механическим стрессом» для пораженных суставов и их связочного аппарата. В этом случае прием небольших доз НПВП коротким курсом (2‒3 дня) может оказаться достаточной мерой для устранения неприятных ощущений и восстановления функциональной активности.
При ОА обострения заболевания нередко носят характер кратковременного повышения интенсивности боли, сопровождающегося скованностью, усилением функциональных проблем, снижением настроения и социальной адаптации [20]. Наглядной иллюстрацией этого может служить работа Е. Parry и соавт. [21], которые оценили частоту и продолжительность рецидивов ОА у 67 больных с этим заболеванием. Предложив пациентам вести дневник, исследователи определили, что в течение месяца обострение ОА возникло у 30 (45%), причем у 16 больных – лишь одно, у 6 – два, у 6 – три, у 2 – четыре; в среднем длительность обострения составляла 8 дней (от 3 до 30). При этом обострение описывалось большинством пациентов как эпизод резкой, пульсирующей, колющей, жгучей боли, сопровождающейся отечностью сустава, хромотой и скованностью; пробуждением от боли, необходимостью принимать большое количество анальгетиков и ограничением повседневной активности.
Срок «подавления» обострения ОА может широко варьировать в зависимости от клинической ситуации и фенотипа болезни. Тем не менее во многих случаях приема НПВП в течение около 5 дней бывает достаточно для значительного уменьшения интенсивности боли и восстановления функций. Это показывает, в частности, работа М. Thomas и соавт. [22], которые оценили траекторию обострения ОА у 449 пациентов. Главным признаком обострения считалось усиление боли до уровня ≥5 по числовой рейтинговой шкале 0‒10. Все больные получали НПВП в течение 5 дней. В результате у 35,5% боль была полностью или практически полностью купирована, а у 28,7% ее интенсивность снизилась на 40‒50%.
Безрецептурный напроксен
Представленные выше данные обосновывают применение в ревматологической практике такого инструмента анальгетической терапии, как безрецептурные НПВП. К этим препаратам относятся готовые лекарственные формы, содержащие относительно небольшие дозы действующего вещества и предназначенные для кратковременного приема ‒ обычно в течение 3‒5 дней. Важным преимуществом безрецептурных НПВП является возможность их свободного приобретения пациентами и использования в рамках «ответственного самолечения» [23,24].
Очевидно, что состояние больного, даже если заболевание эффективно контролируется базисной терапией (базисные противовоспалительные препараты при РА, МДСС при ОА), может быть подвержено определенным колебаниям. При этом пациенты не имеют реальной возможности постоянно обращаться за советами к лечащему врачу [23,24]. Поэтому пациенты должны быть обучены самостоятельно справляться с теми относительно небольшими проблемами, которые могут возникать на амбулаторном этапе лечения, такими как кратковременное усиление боли при РА и ОА, возникающее после физической нагрузки, эмоциональных переживаний или при изменении метеорологических условий, когда проявляется известная многим больным РЗ негативная реакция на плохую погоду [25,26]. Эффективные, относительно безопасные и доступные безрецептурные НПВП могут рассматриваться в данной ситуации как препараты выбора.
Одним из наиболее популярных в мире представителей безрецептурных НПВП является напроксен. В настоящее время этот препарат известен практикующим врачам прежде всего как представитель группы НПВП, обладающий наименьшим риском кардиоваскулярных осложнений [27,28]. Этот факт подтверждается множеством клинических и популяционных исследований, а также соответствующим метаанализом [29].
Положение о кардиобезопасности напроксена было четко обозначено в 2007 году Ассоциацией американских кардиологов, AHA (American Heart Association), в рекомендациях по снижению кардиоваскулярных осложнений при лечении боли, связанной с заболеваниями скелетно-мышечной системы. Как препарат первой линии было предложено использовать парацетамол, в случае его неэффективности ‒ аспирин, а затем трамадол и другие анальгетики опиоидного ряда. При необходимости применения НПВП выбор рекомендовалось начинать именно с напроксена ‒ как самого безопасного для ССС препарата данной фармакологической группы [30].
Эксперты Европейской антиревматической лиги (EULAR) пришли к аналогичному заключению. В соответствии с их рекомендациями назначение напроксена в сочетании с ингибиторами протонной помпы (ИПП) представляется наиболее целесообразным у больных РЗ с высоким риском кардиоваскулярных осложнений [31]. Столь же высокое мнение о безопасности напроксена для ССС было высказано британскими экспертами из национального института здравоохранения и передового опыта (NICE) [32].
Российские эксперты в целом поддерживают мнение западных коллег. Согласно положениям национальных рекомендаций по рациональному использованию НПВП в клинической практике (2018 г.), применение напроксена в комбинации с ИПП – наиболее безопасный подход при необходимости контроля боли у лиц, имеющих сочетание умеренного/высокого риска осложнений со стороны ССС. Назначение низких доз напроксена (до 500 мг/сутки) было отмечено как единственно возможный вариант использования НПВП у больных с кардиоваскулярными осложнениями в анамнезе [33].
Помимо очевидного преимущества в кардиоваскулярной безопасности напроксен является эффективным анальгетиком, который может с успехом применяться как для контроля острой, так и хронической боли.
Терапевтический потенциал напроксена прошел серьезную проверку в ходе серии рандомизированных контролируемых исследований (РКИ), в которых он использовался при самых разных заболеваниях, начиная от лечения острого подагрического артрита и послеоперационной боли и заканчивая многолетней терапией ОА, и сравнивался с плацебо, парацетамолом, опиоидами, другими НПВП и глюкокортикоидами. Во всех случаях применение напроксена обеспечивало действенный обезболивающий и противовоспалительный эффект, не уступающий или превосходящий препараты контроля [27, 28].
Так, хороший анальгетический потенциал напроксена подтверждает метаанализ Кокрановского общества, проведенный С. Derry и соавт. [34]. В этой работе оценивались результаты 10 РКИ (n=996), в которых напроксен в дозе от 200 до 500 мг (однократный прием) сравнивался с плацебо при острой послеоперационной боли, в основном связанной со стоматологическими манипуляциями. Число пациентов, у которых было отмечено уменьшение боли на 50% через 4‒6 час. после приема, составило для напроксена 200 мг – 45%, 400 мг – 49%, 500 мг – 52%; плацебо – от 11 до 16%. Время после приема напроксена, после которого потребовалось дополнительное обезболивание, в среднем составило 8,9 час., плацебо – 2 час.
Исследование S. Smith и соавт. [35] показало, что напроксен не уступает по своей эффективности опиоидным анальгетикам. Эти ученые провели метаанализ ряда РКИ, в которых оценивалось обезболивающее действие нескольких популярных НПВП (в т.ч. напроксена) в сравнении с трамадолом и сильными опиоидами (оксикодоном и гидроморфоном) у пациентов с ОА. Было показано, что динамика боли по индексу WOMAC на фоне приема НПВП, трамадола и более сильных опиоидов в течение 2‒12 нед. не различалась, составив в среднем –18, –18 и –19 мм. При этом на фоне использования напроксена в дозе 750 мг и 1000 мг/сут. уменьшение интенсивности болевых ощущений составило в среднем от 11 до 25 мм.
Как было отмечено выше, имеются зарубежные данные по очень длительному использованию напроксена*. В этом плане большой интерес представляет РКИ H. Williams и соавт. [36], которые сравнили результаты 2-летнего применения напроксена 750 мг/сутки и парацетамола 3000 мг/сутки у 178 больных ОА. Через 2 года наблюдения отмечалась отчетливая тенденция к более действенному контролю боли в группе напроксена, чем парацетамола. Так, динамика боли (10 см ВАШ) в покое составила от 3,0±2,2 до 1,0±1,8 и от 3,0±2,2 до 2,0±2,4; при движении – от 5,0±2,7 до 3,0±2,2 и от 5,0±3,3 до 4,0±3,0 соответственно. Время, необходимое для прохождения расстояния в 50 футов (примерно 15 м), изменилось с 16,0±10,8 до 12,0±5,8 секунд и с 14,0±5,6 до 14,0±6,7 секунд соответственно (р=0,03). При этом число отмен вследствие НР на фоне приема напроксена и парацетамола не различалось, составив 23 и 18% соответственно.
Близкие данные были получены в 12-месячном РКИ A. Temple и соавт. [37], в ходе которого 571 пациент с ОА получали напроксен по 375 мг 2 раза в день или парацетамол по 1000 мг 4 раза в день. Динамика индекса WOMAC на фоне приема умеренной дозы напроксена и максимальной дозы парацетамола не отличалась; при этом число отмен из-за НР составило в группе парацетамола 24,7%, напроксена – 22,2%.
Наиболее показательным среди исследований, в которых оценивалась эффективность напроксена при длительном использовании, является работа J. Reginster и соавт. [38]. В ходе этого 2,5-летнего РКИ проводилось сравнение напроксена 1000 мг/сутки и эторикоксиба 60 мг/сутки у 997 пациентов с ОА. Обезболивающее действие обоих НПВП было примерно одинаковым: индекс WOMAC боли снизился с 67 мм в начале до 33 и 34 мм в конце периода наблюдения. Важно отметить, что осложнения со стороны ССС существенно реже отмечались у больных, получавших напроксен (6 случаев), чем эторикоксиб (13 случаев).
Следует отметить, что низкие дозы напроксена (до 300 мг), которые представлены в ряде безрецептурных анальгетиков, также весьма эффективны для контроля острой/подострой скелетно-мышечной боли. Это демонстрирует, например, работа М. Fathi и соавт. [39], которые сравнили разовое действие 250 мг напроксена и наркотического анальгетика оксикодона 5 мг у 150 пациентов с острой травмой мягких тканей. Эффект оказался примерно одинаковым – через час после приема напроксена интенсивность боли (10-балльная ВАШ) уменьшилась с 6,21 ± 0,9 до 2,5 ± 1,3, оксикодона – с 6,0 ± 1,0 до 2,6 ± 1,3. Важно отметить, что НР достоверно реже возникали при использовании напроксена, чем оксикодона.
По своему анальгетическому потенциалу напроксен соответствует наиболее популярным «ургентным» НПВП, таким как кеторолак. Р. Plapler и соавт. [40] оценили результат применения напроксена 250 мг 3 раза в день и кеторолака 10 мг 3 раза в день у 83 пациентов с острой НБС. После 5 дней лечения динамика болевых ощущений и нарушения функции (по опроснику Роланда ‒ Морриса) на фоне приема обоих препаратов статистически не отличалась. Но потребность в использовании кеторолака при этом была в 2 раза выше, чем напроксена.
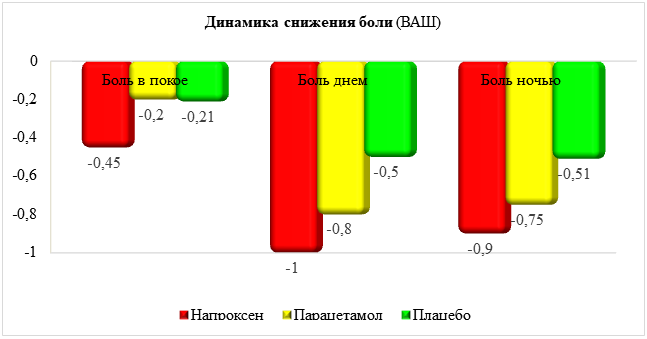
Преимущества напроксена в низких дозах отчетливо видны в работе Н. Golden и соавт. [41], которые оценили результаты 2 идентичных по дизайну РКИ, в которых 445 больных ОА получали напроксен 440/660 мг/сут., парацетамол 4000 мг/сут. или плацебо. Через 7 дней лечения результаты были достоверно лучше в группе напроксена – как в сравнении с плацебо (по всем параметрам), так и парацетамолом (по ряду параметров, в частности боли, возникающей при ходьбе, при сгибании, подъеме и наклонах) (рис.1).
Рисунок 1. Уменьшение боли на фоне приема безрецептурного напроксена (440‒660 мг/сут., парацетамола 4000 мг/сут. и плацебо у 445 больных ОА (адаптировано из исследования Golden H. и соавт. [41]).
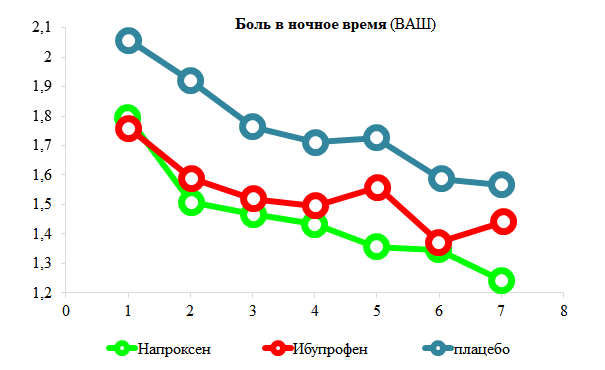
Столь же хороший результат был показан М. Schiff и М. Minic [42] в 2 идентичных по дизайну РКИ, в которых проводилось сравнение напроксена 440/660 мг/сут., ибупрофена 1200 мг/сут. и плацебо у 444 больных ОА. Через неделю терапии эффект напроксена достоверно превосходил плацебо и не отличался, а по некоторым параметрам превосходил результат применения ибупрофена (рис. 2).
Рисунок 2. Сравнение эффективности безрецептурного напроксена (440‒660 мг/сут., ибупрофена 1200 мг/сут. и плацебо у 444 больных ОА (адаптировано из исследования M. Schiff и M. Minic [42]).
Важным преимуществом напроксена является длительность эффекта. Так, в обзоре A. Lila и соавт. представлены данные, свидетельствующие о сохранении обезболивающего действия безрецептурных доз напроксена на протяжении 12‒15 час. [43]. Это преимущество демонстрирует, в частности, исследование А. Cooper и соавт. [44], которые сравнили результат однократного приема напроксена 440 мг, ибупрофена 400 мг и плацебо у 385 пациентов, испытывавших выраженную боль (≥ 5 по числовой рейтинговой шкале 0‒10) после стоматологических операций. Согласно полученным данным, напроксен достоверно превосходил ибупрофен и плацебо по выраженности и длительности анальгетического эффекта. Так, в течение 24 час. после приема напроксена 440 мг дополнительное обезболивание потребовалось лишь 34,9% пациентов, в то время как после приема ибупрофена 400 мг и плацебо – 83,0% и 81,5% соответственно.
Следует отметить, что хотя напроксен является неселективным ингибитором циклооксигеназы-2 и способен (как и все другие представители этой подгруппы НПВП) вызывать осложнения со стороны ЖКТ, безрецептурные формы данного препарата отличает хорошая переносимость и низкий риск развития серьезных гастроинтестинальных НР. Это наглядно показывает исследование V. Bansal и соавт. [45], представляющее метаанализ 46 РКИ, в которых сравнивалась частота осложнений при использовании низких доз напроксена и плацебо. Суммарно участниками этих работ стали 4623 пациентов, принимавших напроксен, и 2659 пациентов, получавших плацебо. В 22 РКИ напроксен использовался однократно 220 мг, в 15 назначались множественные дозы (440‒660 мг/сутки), а в 9 он применялся в режиме «по требованию». В итоге суммарная частота НР при использовании низких доз напроксена не превышала количество НР у пациентов, получавших плацебо. Отношение шансов (ОШ) ЖКТ-осложнений для однократного приема низкой дозы напроксена было равно 0,925, для множественного приема низких доз ‒ 0,830, для приема по требованию ‒ 0,998. Во всех случаях различие оказалось недостоверным в сравнении с плацебо.
В отношении кардиоваскулярного риска безрецептурный напроксен практически безопасен. Это подтверждают результаты масштабного исследования Р. McGettigan и D. Henry [46], представляющего метаанализ 30 исследований случай–контроль (n=184,946) и 21 когортного исследования (популяция >2,7 млн лиц). При использовании как низких, так и высоких доз напроксена риск ИМ не повышался: ОШ составило 0,97 и 1,05. Иные показатели были определены для диклофенака и ибупрофена. Так, если использование низких доз этих препаратов ассоциировалось с минимальным риском развития ИМ – ОШ 1,22 и 1,05, то применение высоких доз резко увеличивало опасность – ОШ 1,98 и 1,78.
Таким образом, напроксен в низких дозах может с успехом использоваться для кратковременного контроля скелетно-мышечной боли при РЗ. Сейчас в арсенале российского врача имеется новый препарат безрецептурного напроксена ‒ «Тералив 275». Использование этого лекарства может быть показано при различных клинических ситуациях (табл.1). Важно отметить, что кратковременное (до 5 дней в соответствии с инструкцией) применение «Тералива 275» ассоциируется с очень низким риском лекарственных осложнений и не требует специального врачебного контроля, поэтому может осуществляться в рамках «ответственного самолечения» пациента. Конечно, при рекомендации больным использовать данный препарат следует учитывать все факторы риска и противопоказания, отмеченные как в национальных рекомендациях по применению НПВП, так и в инструкции фирмы-производителя. Представляется, что появление этого препарата существенно расширяет возможности медицинской помощи пациентам с РЗ, в первую очередь – находящимся на амбулаторном этапе лечения.
*в США и некоторых других странах напроксен в безрецептурных дозировках (Aleve®) зарегистрирован без ограничения длительности применения.
Таблица 1. Безрецептурные НПВП в ревматологической практике.
|
Категории пациентов |
Показания для кратковременного использования напроксена в низких дозах |
|
● Пациенты с РА и ПсА, получающие с- БПВП с/без б-БПВП или тс-БПВП в состоянии ремиссии/низкой активности |
Кратковременное усиление боли, вызванное нагрузкой (часто ‒ вследствие повреждения или воспаления околосуставных мягких тканей) |
|
● Пациенты с РА и ОА в стадии обострения |
Необходимость применения НПВП в комплексном лечении выраженной боли у пациентов с высоким кардиоваскулярным риском |
|
● Пациенты с благоприятным течением ОА (например, на фоне приема МДСС) при амбулаторном наблюдении |
Кратковременное обострение, связанное с чрезмерным напряжением, эмоциональным переживаем или изменением погоды (при первом появлении боли) |
|
● Пациенты с острой/подострой НБС |
Дебют терапии в амбулаторных условиях (при первом появлении боли) |
|
● Пациенты с хронической НБС при амбулаторном наблюдении |
Кратковременное обострение, связанное с чрезмерным напряжением, эмоциональным переживаем или изменением погоды (при первом появлении боли) |
|
● Пациенты с острой/подострой болью, связанной с поражением околосуставных мягких тканей (синдром сдавления ротаторов плеча, эпикондилит, синдром Де Кервена, бурсит «гусиной лапки» и др.) |
Дебют терапии в амбулаторных условиях (при первом появлении боли) |
|
● Пациенты со стабильным течением РЗ (не получающие регулярно рецептурные НПВП) |
Кратковременная боль, не связанная с РЗ: головная боль, зубная боль, дисменорея, боль после небольших травм, необходимость жаропонижающей терапии при ОРВИ и др. |
РА – ревматоидный артрит, ПсА-псориатический артрит, ОА – остеоартрит, НБС – неспецифическая боль в спине, с-БПВП – синтетические базисные противовоспалительные препараты, б-БПВП – биологические базисные противовоспалительные препараты, тс-БПВП – таргетные синтетические противовоспалительные препараты, МДСС – медленнодействующие симптоматические средства (SYSADOA).
Об авторе:
Каратеев Андрей Евгеньевич, д.м.н., заведующий лабораторией патофизиологии боли и полиморфизма скелетно-мышечных заболеваний ФГБНУ «Научно-исследовательский институт ревматологии им. В.А.Насоновой». ORCID 0000-0002-1391-0711.
Для корреспонденции: Каратеев Андрей Евгеньевич, 115522, г. Москва, Каширское шоссе, 34A, Российская Федерация. Тел.: +7 (495) 109 29 10. E-mail: aekarat@yandex.ru.
Литература:
1. Насонов Е.Л., Яхно Н.Н., Каратеев А.Е. и др. Общие принципы лечения скелетно-мышечной боли: междисциплинарный консенсус. Научно-практическая ревматология. 2016;54(3):247-265. https://doi.org/10.14412/1995-4484-2016-247-265.
2. Cao Y, Fan D, Yin Y. Pain Mechanism in Rheumatoid Arthritis: From Cytokines to Central Sensitization. Mediators Inflamm. 2020 Sep 12;2020:2076328. doi: 10.1155/2020/2076328. eCollection.
3. Berenbaum F, Walker C. Osteoarthritis and inflammation: a serious disease with overlapping phenotypic patterns. Postgrad Med. 2020 May;132(4):377-384. doi: 10.1080/00325481.2020.1730669. Epub 2020 Feb 26.
4. Lampa J. Pain without inflammation in rheumatic diseases. Best Pract Res Clin Rheumatol. 2019 Jun;33(3):101439. doi: 10.1016/j.berh.2019.101439. Epub 2019 Sep 6.
5. Lwin MN, Serhal L, Holroyd C, Edwards CJ. Rheumatoid Arthritis: The Impact of Mental Health on Disease: A Narrative Review. Rheumatol Ther. 2020 Sep;7(3):457-471. doi: 10.1007/s40744-020-00217-4. Epub 2020 Jun 13.
6. Pincus T, Castrejon I, Yazici Y, et al. Osteoarthritis is as severe as rheumatoid arthritis: evidence over 40 years according to the same measure in each disease. Clin Exp Rheumatol. 2019 Sep-Oct;37 Suppl 120(5):7-17. Epub 2019 Oct 14.
7. Harth M, Nielson WR. Pain and affective distress in arthritis: relationship to immunity and inflammation. Expert Rev Clin Immunol. 2019 May;15(5):541-552. doi: 10.1080/1744666X.2019.1573675. Epub 2019 Feb 11.
8. Michaud K, Pope J, van de Laar M., et al. A Systematic Literature Review of Residual Symptoms and Unmet Need in Patients with Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2020 Jul 3. doi: 10.1002/acr.24369. Online ahead of print.
9. Vergne-Salle P., Pouplin S., Trouvin A. et al. The burden of pain in rheumatoid arthritis: Impact of disease activity and psychological factors. Eur J Pain. 2020 Aug 25. doi: 10.1002/ejp.1651. Online ahead of print.
10. Steffen А., Holstiege , Klimke K., et al. Patterns of the initiation of disease-modifying antirheumatic drugs in incident rheumatoid arthritis: a German perspective based on nationwide ambulatory drug prescription data. Rheumatol Int. 2018 Nov;38(11):2111-2120. doi: 10.1007/s00296-018-4161-7. Epub 2018 Oct 10.
11. Charlesworth J, Fitzpatrick J, Perera NKP, Orchard J. Osteoarthritis- a systematic review of long-term safety implications for osteoarthritis of the knee. BMC Musculoskelet Disord. 2019 Apr 9;20(1):151. doi: 10.1186/s12891-019-2525-0.
12. Akazawa M, Mimura W, Togo K, et al. Patterns of drug treatment in patients with osteoarthritis and chronic low back pain in Japan: a retrospective database study. J Pain Res. 2019 May 21;12:1631-1648. doi: 10.2147/JPR.S203553. eCollection 2019.
13. Zeng C., Zhang W., Doherty M. et al. Initial analgesic prescriptions for osteoarthritis in the United Kingdom, 2000-2016. Rheumatology (Oxford). 2020 Jun 28;keaa244. doi: 10.1093/rheumatology/keaa244. Online ahead of print.
14. Rane MA, Gitin A, Fiedler B, Fiedler L, Hennekens CH. Risks of Cardiovascular Disease and Beyond in Prescription of Nonsteroidal Anti-Inflammatory Drugs. J Cardiovasc Pharmacol Ther. 2020 Jan;25(1):3-6. doi: 10.1177/1074248419871902. Epub 2019 Aug 29.
15. Braun J, Baraliakos X, Westhoff T. Nonsteroidal anti-inflammatory drugs and cardiovascular risk - a matter of indication. Semin Arthritis Rheum. 2020 Apr;50(2):285-288. doi: 10.1016/j.semarthrit.2019.07.012.
16. Bjarnason I, Scarpignato C, Holmgren E, et al. Mechanisms of Damage to the Gastrointestinal Tract From Nonsteroidal Anti-Inflammatory Drugs. Gastroenterology. 2018 Feb;154(3):500-514. doi: 10.1053/j.gastro.2017.10.049. Epub 2017 Dec 6.
17. Wongrakpanich S, Wongrakpanich A, Melhado K, Rangaswami J. A Comprehensive Review of Non-Steroidal Anti-Inflammatory Drug Use in The Elderly. Aging Dis. 2018 Feb 1;9(1):143-150. doi: 10.14336/AD.2017.0306. eCollection 2018 Feb.
18. Cooper C, Chapurlat R, Al-Daghri N, et al. Safety of Oral Non-Selective Non-Steroidal Anti-Inflammatory Drugs in Osteoarthritis: What Does the Literature Say? Drugs Aging. 2019 Apr;36(Suppl 1):15-24. doi: 10.1007/s40266-019-00660-1.
19. Bally M, Beauchamp ME, Abrahamowicz M, et al. Risk of acute myocardial infarction with real-world NSAIDs depends on dose and timing of exposure. Pharmacoepidemiol Drug Saf. 2018 Jan;27(1):69-77. doi: 10.1002/pds.4358. Epub 2017 Nov 24.
20. Guillemin F, Ricatte C, Barcenilla-Wong A, et al. Developing a Preliminary Definition and Domains of Flare in Knee and Hip Osteoarthritis (OA): Consensus Building of the Flare-in-OA OMERACT Group. J Rheumatol. 2019 Sep;46(9):1188-1191. doi: 10.3899/jrheum.181085. Epub 2019 May 15.
21. Parry E, Ogollah R2, Peat G. 'Acute flare-ups' in patients with, or at high risk of, knee osteoarthritis: a daily diary study with case-crossover analysis. Osteoarthritis Cartilage. 2019 Aug;27(8):1124-1128. doi: 10.1016/j.joca.2019.04.003. Epub 2019 Apr 14.
22. Thomas MJ, Yu D, Nicholls E, et al. Short-term recovery trajectories of acute flares in knee pain: a UK-Netherlands multi-centre prospective cohort analysis. Arthritis Care Res (Hoboken). 2019 Oct 10;10.1002/acr.24088. doi: 10.1002/acr.24088.
23. Каратеев А.Е. Пациент с остеоартритом вне «поля зрения» врача: как контролировать боль в суставах в рамках концепции «ответственного самолечения»? Неврология, нейропсихиатрия, психосоматика. 2019;11(Прил. 2):52-61. DOI: 10.14412/2074-2711-2019-2S-52-61.
24. Noone J, Blanchette CM. The value of self-medication: summary of existing evidence. J Med Econ. 2018 Feb;21(2):201-211. doi: 10.1080/13696998.2017.1390473. Epub 2017 Nov 3.
25. Ferreira ML, Zhang Y, Metcalf B, et al. The influence of weather on the risk of pain exacerbation in patients with knee osteoarthritis - a case-crossover study. Osteoarthritis Cartilage. 2016 Dec;24(12):2042-2047. doi: 10.1016/j.joca.2016.07.016. Epub 2016 Aug 1.
26. Peultier L, Lion A, Chary-Valckenaere I, et al. Influence of meteorological elements on balance control and pain in patients with symptomatic knee osteoarthritis. Int J Biometeorol. 2017 May;61(5):903-910. doi: 10.1007/s00484-016-1269-x. Epub 2016 Nov 10.
27. Brutzkus JC, Shahrokhi M, Varacallo M. Naproxen. 2020 May 24. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan–. PMID: 30247840.
28. Angiolillo D., Weisman S. Clinical Pharmacology and Cardiovascular Safety of Naproxen. Am J Cardiovasc Drugs. 2017 Apr;17(2):97-107. doi: 10.1007/s40256-016-0200-5.
29. Bhala N, Emberson J, Merhi A, et al. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Coxib and traditional NSAID Trialists' (CNT) Collaboration. Lancet. 2013 Aug 31;382(9894):769-79. doi: 10.1016/S0140-6736(13)60900-9. Epub 2013 May 30.
30. Antman E., Bennett J., Daugherty A., et al. Use of Nonsteroidal Antiinflammatory Drugs. An Update for Clinicians: A Scientific Statement From the American Heart Association. Circulation. 2007 Mar 27;115(12):1634-42. doi: 10.1161/CIRCULATIONAHA.106.181424. Epub 2007 Feb 26.
31. Burmester G., Lanas A., Biasucci L., et al. The appropriate use of non-steroidal anti-inflammatory drugs in rheumatic disease: opinions of a multidisciplinary European expert panel. Ann Rheum Dis. 2011 May;70(5):818-22. doi: 10.1136/ard.2010.128660. Epub 2010 Sep 10.
32. https://www.nice.org.uk/advice/ktt13/resources/nonsteroidal-antiinflammatory-drugs-pdf-58757951055301.
33. Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т., и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018;56:1-29. https://doi.org/10.14412/1995-4484-2018-1-29.
34. Derry C, Derry S, Moore RA, McQuay HJ. Single dose oral naproxen and naproxen sodium for acute postoperative pain in adults. Cochrane Database Syst Rev. 2009 Jan 21;2009(1):CD004234. doi: 10.1002/14651858.CD004234.pub3.
35. Smith SR, Deshpande BR, Collins JE, Katz JN, Losina E. Comparative pain reduction of oral non-steroidal anti-inflammatory drugs and opioids for knee osteoarthritis: systematic analytic review. Osteoarthritis Cartilage. 2016 Jun;24(6):962-72. doi: 10.1016/j.joca.2016.01.135. Epub 2016 Feb 1.
36. Williams H, Ward J, Egger M, et al. Comparison of naproxen and acetaminophen in a two-year study of treatment of osteoarthritis of the knee. Arthritis Rheum. 1993 Sep;36(9):1196-206. doi: 10.1002/art.1780360904.
37. Temple AR, Benson GD, Zinsenheim JR, Schweinle JE. Multicenter, randomized, double-blind, active-controlled, parallel-group trial of the long-term (6-12 months) safety of acetaminophen in adult patients with osteoarthritis. Clin Ther. 2006 Feb;28(2):222-35. doi: 10.1016/j.clinthera.2006.02.004.
38. Reginster J., Malmstrom K., Mehta A., et al. Evaluation of the efficacy and safety of etoricoxib compared with naproxen in two, 138-week randomised studies of patients with osteoarthritis. Ann Rheum Dis. 2007 Jul;66(7):945-51. doi: 10.1136/ard.2006.059162. Epub 2006 Dec 1.
39. Fathi M, Zare MA, Bahmani HR, Zehtabchi S. Comparison of oral oxycodone and naproxen in soft tissue injury pain control: a double-blind randomized clinical trial. Am J Emerg Med. 2015 Sep;33(9):1205-8. doi: 10.1016/j.ajem.2015.05.021. Epub 2015 May 29.
40. Plapler P.G., Scheinberg M.A., Ecclissato C.C., et al. Double-blind, randomized, double-dummy clinical trial comparing the efficacy of ketorolac trometamol and naproxen for acute low back pain. Drug Design, Development and Therapy 2016 10 (1987-1993).
41. Golden HE, Moskowitz RW, Minic M. Analgesic efficacy and safety of nonprescription doses of naproxen sodium compared with acetaminophen in the treatment of osteoarthritis of the knee. Am J Ther. 2004 Mar-Apr;11(2):85-94. doi: 10.1097/00045391-200403000-00002.
42. Schiff M, Minic M. Comparison of the analgesic efficacy and safety of nonprescription doses of naproxen sodium and Ibuprofen in the treatment of osteoarthritis of the knee. J Rheumatol. 2004;31(7):1373-1383.
43. Lila AM, Parfenov VA, Cattry E, Paredes-Diaz A.Pharmacokinetic linearity of naproxen and efficacy of naproxen sodium at various doses. Int J Clin Pharmacol Ther. 2020 Jun;58(6):316-331. doi: 10.5414/CP203696.
44. Cooper S., Desjardins P., Brain P., et al. Longer analgesic effect with naproxen sodium than ibuprofen in post-surgical dental pain: a randomized, double-blind, placebo-controlled, single-dose trial. Curr Med Res Opin. 2019 Dec;35(12):2149-2158. doi: 10.1080/03007995.2019.1655257. Epub 2019 Aug 27.
45. Bansal V, Dex T, Proskin H, Garreffa S. A look at the safety profile of over-the-counter naproxen sodium: a meta-analysis. J Clin Pharmacol. 2001 Feb;41(2):127-38. doi: 10.1177/00912700122009935.
46. McGettigan P., Henry D. Cardiovascular risk with nonsteroidal anti-inflammatory drugs: systematic review of population-based controlled observational studies. PLoS Med. 2011 Sep;8(9):e1001098. doi: 10.1371/journal.pmed.1001098. Epub 2011 Sep 27.
Материал партнера: Bayer















