Комплексный подход: патогенетическая и рациональная терапия вульвовагинального кандидоза
Спорный орган
В системе человек/микроорганизм, общее количество человеческих клеток составляет 1013, а микробных – 1014-1015 (около 2 кг веса).3 И каждый из этих миллиардов (сто биллионов-биллиард!) микроорганизмов функционирует, метабилизирует внутри макроорганизма, то есть человека. Без сомнения, эта армада микробов не может не оказывать определенного воздействия на организм хозяина.4
В последние годы появилось много работ, рассматривающих организации сложных сообществ микроорганизмов – биопленки, сбалансированные по видовому и функциональному составу.
Без сомнения, эта микроэкологическая система чрезвычайно сложная (по количественному и качественному составу микроорганизмов), филогенетически сложившаяся, представляет огромный интерес для фундаментальной науки.
От фундаментальной науки к клинической практике
В начале нынешнего века представления об эндоэкологии человека, его микробиоте стали достоянием не только фундаментальной микробиологии, но и клинической медицины, серьезно озабоченной глобальным ростом заболеваний, называемых «цивилизационными» (сердечно-сосудистых, онкологических и т.д.).
Нарушения состава нормальной микроэкологической системы сегодня принято называть дисбактериозом (дисбиозом), то есть состоянием, при котором нарушается состав и численность микрофлоры. Исчезают базовые анаэробы (или резко снижается их число) – бифидобактерии, бактероиды, лактобациллы. Растет число аэробов (в первую очередь условно-патогенных и патогенных). Как правило, дисбиотические изменения исчезают (самовосстановление) вскоре после устранения причины, вызвавшей их (стресс, сопутствующие заболевания, хирургическое вмешательство, приобретенные или наследуемые нарушения иммунной регуляции, медикаментозное воздействие, влияние радиации, тяжелых металлов и др.). Но при длительном воздействии провоцирующего фактора может формироваться состояние дисбиоза, появляются клинические симптомы.
Наиболее полное представление на сегодняшний день сформировалось о самом большом пуле эндосимбионтов – микробиоте желудочно-кишечного тракта. Большое внимание уделяется и микрофлоре половых путей. Ее норма напрямую связана с гомеостатичностью качественного и количественного состава при «своих» штаммах, не вызывающих реакции иммунной системы (воспаления). Как и нормофлора кишечника, микробиота половых путей выполняет важные физиологически функции и участвует в поддержании гомеостаза женского организма. Она включает в себя как неспецифические факторы: физико-химические – рН, редокс-потенциал, вязкость; химические – низкомолекулярные метаболиты микробиоты, так и специфические, в которых участвуют нейтрофилы и другие фагоцитирующие клетки. Лишь после прорыва специфического звена инициируется включение всех последующих неспецифических и специфических факторов защиты макроорганизма.5 А микроорганизмы, входящие в это сообщество, производят многочисленные биологически активные продукты: ферменты, антибиотики (актиномицеты, стрептомицеты, грибы), регуляторные факторы, витамины. Они участвуют в поддержании рН среды и баланса микроэлементов.
Количественный бактериологический анализ вагинального сообщества здоровых женщин показал, что в 1 г. вагинальной жидкости содержится 108 клеток аэробных и 109 клеток анаэробных бактерий.6 Ведущие микроорганизмы – Lactobacillus, Peptococcus, Bacteroides, Staphilococcus epidermidis, Corinebacterium spp., Peptostreptococcus spp., Eubacterium. Это доминирующие микроорганизмы, чья концентрация – более 105 КОЕг.
Это – в норме, когда отношения человек / микробиота несомненно носят характер симбиоза. Но в неблагоприятных условиях, вызванных различными воздействиями на организм (стресс и пр.) или на микробиоту (антибиотикотерапия), симбиоз может превращаться в отношения взаимной агрессии, когда и тот, и другой его участник может нанести «оппоненту» значительный ущерб: эпителий может вырабатывать бактериостатические и бактерицидные ферменты (лизоцим, лактоферрин), в него начинают проникать активированные фагоцитирующие клетки (нейтрофилы). А бактерии, в свою очередь, активируют собственный ферментативный аппарат (нейраминидазы, гиалуронидазы), высвобождаются эндотоксины и синтезируются другие факторы вирулентности.
При таком представлении о характере взаимоотношений в системе человек / микробиота становятся понятными трудности, возникающие при лечении, к примеру, пациентов с кандидозом.
«Против» кандиды, «за» нормофлору
Увеличение частоты и тяжести ряда инфекционных заболеваний, латентное течение и хронизация воспалительных процессов, связываемые многими специалистами с нарушениями микробиоты или дисбактериозами, заставляют клиницистов искать новые и эффективные способы их коррекции. А фармакологам предлагать им для этого эффективные средства. И примером такого современного средства может быть противогрибковый препарат, предназначенный для терапии вульвовагинального кандидоза (ВВК) с пребиотиком – Экофуцин® (АВВА РУС АО, Россия).
ВВК обусловлен избыточным ростом дрожжеподобных грибов рода Candida. Но за последнее десятилетие его частота практически удвоилась – достигнув 30–45% в структуре инфекционных поражений вульвы и влагалища. До 70–75% женщин в течение жизни имеют хотя бы один эпизод ВВК, при этом в 5–10% случаев заболевание становится рецидивирующим (около 3 млн. случаев в год).7-10
ВВК негативно влияет на качество жизни, психологическое состояние и сексуальную активность женщин, требуя немедленного лечения и учета высокого риска рецидива.
Как уже следует из названия, этиологический фактор заболевания – грибы рода Candida (Candida albicans – доминирующий возбудитель заболевания, выявляемый у 90% больных ВВК; также представители Candida non-albicans, выявляемые, как правило, при рецидивирующем ВВК, протекающем на фоне других заболеваний), причем в последние годы наблюдается явная тенденция к увеличению распространения ВВК, обусловленного именно видами Candida non-albicans.7-8 Эти микроорганизмы – представители нормального микробиома человека, то есть присутствующие в здоровом организме в качестве либо симбионтов, либо комменсалов вместе с лактобациллами.
Но при воздействии экзогенных и эндогенных факторов, о которых уже говорилось ранее, при беременности (увеличении гликогена в эпителии влагалища), при снижении резистентности организма формируется ощутимый дефицит лактобактерий и увеличивается количество С. albicans, начинают проявляться ее патогенные свойства, провоцирующие начало и развитие заболевания.11-19 При этом эксперты отмечают сложности в понимании патогенеза заболевания: штаммы C. albicans, выделенные у больных ВВК и у здоровых носителей, по ряду биохимических характеристик существенно не различаются. Таким образом, основная роль принадлежит не столько свойствам возбудителя, сколько состоянию макроорганизма и его микробиома.13-14
Традиционно целью медикаментозного лечения ВВК является эрадикация возбудителя. Большинство случаев поддается терапии местными противогрибковыми средствами и антисептиками. Интравагинальные формы ЛС безопасны (системная абсорбция практически отсутствует), быстро обеспечивают купирование симптомов, а высокие концентрации антимикотиков на поверхности слизистой уменьшают вероятность развития устойчивости.
Экофуцин® – антибиотик полиенового ряда с действующим веществом натамицин, оказывающий фунгицидное действие на грибы и дрожжи, связываясь со стеролами клеточной мембраны гриба, активен в отношении большинства дрожжеподобных грибов, особенно Candida albicans и Candida glabrata, часто обнаруживаемых у пациенток с ВВК.
Тем не менее, даже адекватная этиотропная терапия не всегда позволяет предупредить рецидивы заболевания.15-16 Это, в частности, может быть связано с тем, что самостоятельное восстановление микробиоты влагалища не всегда возможно. Предупредить обострения можно, восстановив вагинальный биотоп. Поэтому важным аспектом терапии ВВК становится восстановление нормальной микрофлоры влагалища, чтобы физиологические механизмы колонизации слизистой сапрофитами способствовали подавлению роста патогенных грибов.17 Как известно, важным (и доминирующим) компонентом резидентной микрофлоры влагалища выступают молочнокислые бактерии (L. acidophilus, L. plantarium, L. casei и др.). Именно они препятствуют росту болезнетворных микроорганизмов, выступая в роли антагонистов грибов рода Candida, но не в случае угнетенного и ослабленного микробиома.
Ученые давно обратили на это внимание. И в Европе врачи рекомендуют применение свечей с лактобактериями (пробиотик) для местного применения. Особенно эта форма актуальна для беременных женщин с ВВК.
Про- и пре-
Препараты, содержащие живые бактерии и предназначенные для коррекции разнообразных дисбиотических сдвигов (пробиотики), нашли широкое распространение и в нашей стране. Безопасность их использования – достаточно хорошо установленный факт. Но клинические исследования пробиотиков пока показывают лишь кратковременный эффект. По данным Кохрейновского обзора (2017 г.), пробиотики в краткосрочной перспективе несколько улучшают эффективность антимикотического средства и значимо снижают частоту рецидивов, но только в течение 1 месяца.20 Длительного протективного влияния авторы не обнаружили.
А с расширением спектра показаний для их назначения стала появляться информация о том, что их положительный эффект даже при длительном применении нередко носит транзиторный характер. Одной из главных причин этих неудач многие авторы считают чужеродность для человека входящих в их состав микроорганизмов, высокую видовую, индивидуальную и анатомическую специфичность автохтонной микрофлоры пациентов (из более 10 видов лактобацилл, обнаруживаемых во влагалищах, не удается определить ни одного вида, который бы присутствовал у всех женщин).18
Некоторые специалисты считают, что коллективный иммунитет биопленки практически сводит на нет результат коррекции дисбактериозов пробиотиками. Несомненно, они создают эффект, но не всегда и не такой, как предполагалось. Возможно, правы те авторы, кто считает, что каждый пациент имеет свой уникальный (индивидуальный) штаммовый пейзаж индигенной микробиоты, постоянство которого обеспечивает иммунная система индивидуума. Он генетически детерминирован.19
Кроме того, широкое лечебно-профилактическое применение пробиотиков имеет еще один ограничивающий фактор – экономический, связанный с достаточно высокой стоимостью препаратов.
Механизмы положительного влияния молочнокислых бактерий и бифидобактерий на организм:6
- ингибирование роста потенциально вредных микроорганизмов в результате продукции антимикробных субстанций; конкуренции с ними за рецепторы адгезии и питательные вещества; активации иммунно-компетентных клеток и стимуляции иммунитета;
- стимуляция роста представителей облигатной микрофлоры в результате продукции витаминов и других ростостимулирующих факторов; нормализации рН, окислительно-восстановительного потенциала; нейтрализация токсинов;
- восстановление и оптимизация функционирования биопленки;
- изменение микробного метаболизма, ведущего к повышению или снижению синтеза и активности бактериальных ферментов и, как следствие, продукции соответствующих метаболитов (например, ЛЖК, глютамина, аргинина, витаминов, пептидогликанов и т. д.), обладающих способностью местно или после проникновения в кровь и другие биологические жидкости макроорганизма непосредственно вмешиваться в метаболическую активность клеток соответствующих органов и тканей. Модулировать его морфокинетические характеристики, физиологические функции, биохимические и поведенческие реакции.
Альтернативным и более перспективным подходом, направленным на восстановление микробиоты, можно считать использование пребиотиков, которые, являясь питательной средой для размножения собственной нормофлоры, способны длительно стимулировать и поддерживать ее рост.22 Это препараты немикробного происхождения, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством – способностью оказывать позитивный эффект на организм хозяина путем селективной стимуляции роста или активизации метаболической функции нормальной микробиоты.
Один из них – лактулоза – синтетический дисахарид. Она активно ферментируется нормальной микрофлорой влагалища, стимулируя рост «своих» бифидо- и лактобактерий. Лактулоза уже более 40 лет применяется в педиатрии для стимуляции роста лактобактерий у детей грудного возраста.12
Механизм действия лактулозы
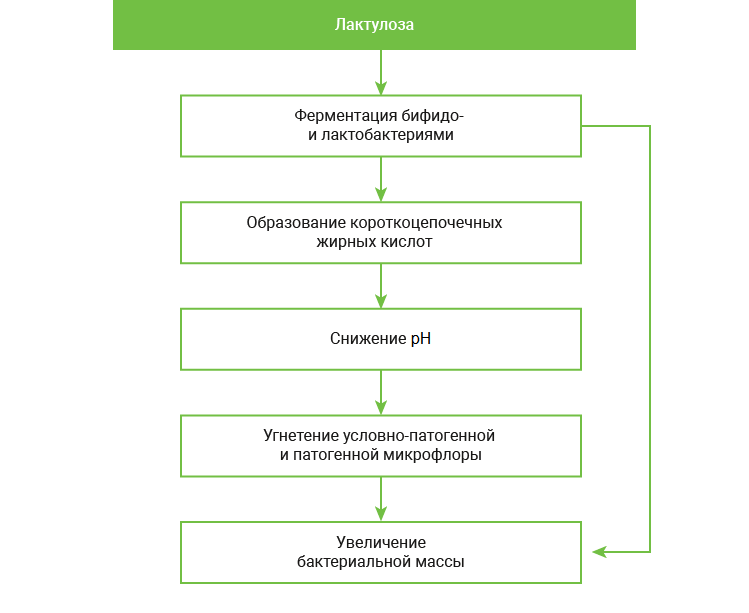
В недавно опубликованной работе авторы изучили in vitro реакцию лактобацилл, кандид и др. на различные пребиотики. По полученным данным, лактулоза наиболее активно и избирательно стимулирует лактобациллы влагалища, включая L. crispatus. Было также доказано, что C. albicans не усваивают лактулозу, оставаясь без питания. На этом основании ученые рекомендовали включать этот дисахарид в комбинированную терапию ВВК и при остром процессе, и при долечивании.23
Именно лактулоза стала вторым компонентом препарата Экофуцин® (100 мг натамицина и стимулятор роста нормальной микрофлоры влагалища – пребиотик лактулоза в дозировке 300 мг).
Комплексное действие этого отечественного препарата Экофуцин® (суппозитории вагинальные), его эффективность и безопасность были продемонстрированы в многоцентровом открытом сравнительном рандомизированном исследовании, проведенном в клинических центрах Санкт-Петербурга и Омской государственной медицинской академии.24
В исследование вошли пациентки в возрасте от 18 до 45 лет с острым кандидозным вагинитом/вульвовагинитом. В 1-й группе (n = 36), основной, наблюдаемые принимали Экофуцин®, во – 2-й (n = 36), контрольной, препарат зарубежного производства с действующим веществом натамицин (100 мг), но без пребиотика. Длительность терапии – 6 дней.
Таблица. Число пациенток с клиническими проявлениями после начала терапии исследуемыми препаратами28
|
День терапии |
Число пациенток с клиническими проявлениями 1-я группа (Экофуцин®: натамицин + лактулоза) | Число пациенток с клиническими проявлениями 2-я группа (натамицин) | p | ||
| отсутствуют | имеются | отсутствуют | имеются | ||
| 4-й | 27 | 9 | 23 | 13 | 0,215 |
| 7-й | 29 | 7 | 20 | 16 | 0,022 |
| 37-й | 29 | 7 | 32 | 4 | 0,690 |
Эффективность и безопасность исследуемых препаратов оценивали по результатам осмотра, лабораторного исследования, по данным дневников пациенток. Контрольные визиты проводили на 4, 7 и 37-й (± 2) день от начала лечения.
Результаты исследования:24 комбинация противогрибкового препарата натамицина и пребиотика в составе интравагинальных свечей способствует более быстрому достижению клинической и микробиологической ремиссии, т.е. полной элиминации возбудителя, а также приводит к интенсивному росту лактобактерий (содержание вагинальных Lactobacillus spp. до начала терапии значимо не различалось – 0,3 и 0,6 lg КОЕ/мл; а на 37-е сутки достоверно большее количество молочнокислых палочек было зарегистрировано в группе комбинированного лечения: 4 lg КОЕ/мл по сравнению с 2,1 lg во 2-й, контрольной, группе, разница почти в 100 раз), являющихся основными конкурентами дрожжеподобных грибов во влагалищной микробиоте.
Рисунок. Содержание Lactobacillus spp. в мазках пациенток, применявших натамицин + лактулоза и натамицин до начала терапии и через 37 суток после начала терапии28

Исследование продемонстрировало хорошую переносимость Экофуцина® пациентками, побочных эффектов в ходе проведенного исследования не было зарегистрировано.24
Экофуцин® – это инновационная комбинация натамицина и лактулозы имеет преимущества:
- активно устраняет грибы рода Candida (Candida albicans и Candida non-albicans);
- восстанавливает микробиоту влагалища, повышая уровень лактобактерий, и предотвращает развитие рецидивов заболевания;
- может применяться с первых дней беременности и при различной сопутствующей патологии, т. к. отсутствует системное действие;
- удобство применения – 1 раз в день;
- входит в стандарты лечения кандидоза.
Подводя итоги, следует еще раз подчеркнуть, насколько важным физиологическим партнером организма-хозяина является микробиота половых органов женщин. Она гомеостатична, участвует в обменных процессах на слизистой и защите от внешних патогенов. В то же время она может проявлять враждебность, если ее состав нарушен.
Терапия кандидоза, заболевания, вызванного грибами рода Candida и чья патогенная активность спровоцирована подобными нарушениями, с учетом новых научных знаний о взаимосвязях системы человек / микробиота, должна быть комплексной и включать не только элиминацию возбудителя, но и восстановление естественного защитного барьера. Оба этих направления лечения были успешно учтены создателями противогрибкового препарата с пребиотиком Экофуцин®, предназначенного для адекватной терапии кандидоза. Эффективный и безопасный, он сокращает срок лечения заболевания, предотвращает развитие его рецидивов, делая вагинальное использование лактулозы вместе со стандартным местным лечением противогрибковыми препаратами перспективным направлением в терапии ВВК.
Литература:















Нет комментариев
Комментариев: