Влияние пробиотиков на иммунитет ребенка
Важным звеном иммунной системы человека является лимфоидная ткань желудочно-кишечного тракта (ЖКТ) – до 80% всех иммунокомпетентных клеток локализовано именно там. Микробиота и эпителиальные клетки кишечника (ЭКК) также участвуют в обеспечении защиты организма от патогенов. Интестинальная микрофлора способствует взаимодействию ЭКК и иммунных клеток кишечника, синтезу секреторного IgA (sIgA), запуску и последующей активации факторов защиты (лизоцима, пропердина, системы комплемента), стимуляции интерферонов (ИФН) и цитокинов. Доказана роль микробиоты в усилении иммунных реакций не только в ЖКТ, но и в респираторном тракте. Основная роль при этом отводится Toll-подобным рецепторам (TLR), которые распознают структуры бактериальных клеток и активируют клеточный иммунный ответ4.
Сбалансированная микробиота кишечника генерирует синтез метаболитов бактерий (бутират), длинноцепочечные жирные кислоты, жирорастворимые витамины А и D, влияющие на местный и системный иммунитет. Ацетат SCFAs и пропионат усиливают активность дендритных клеток, интерлейкинов (IL), фагоцитарную функцию макрофагов и баланс Tregs, что приводит к контролю микробиоты легкого5 (рис. 1).
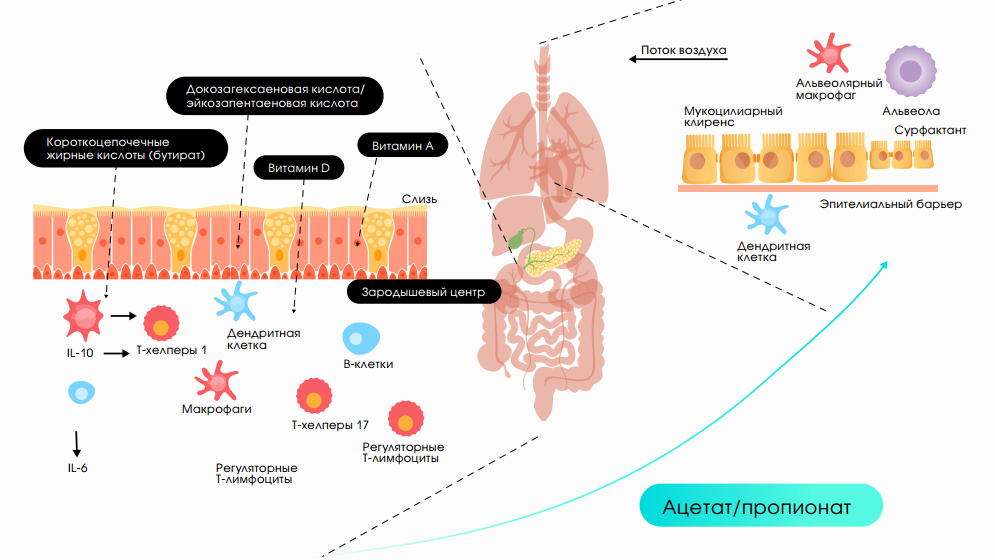
Рис.1.
Один из самых безопасных способов неспецифического воздействия на иммунную систему – применение пробиотиков6. Наиболее часто исследуемыми штаммами у детей являются Lactobacillus rhamnosus GG (LGG, идентификатор ATCC 53103) и Bifidobacterium animalis subsp. lactis BB-12 (ВВ-12). Так, в исследовании М. Kumpu et al. (2012) на фоне приема пробиотика, содержащего LGG, у детей число дней с симптомами острой респираторной вирусной инфекции (ОРВИ) было значительно меньше, чем у детей, получавших плацебо7. Помимо уменьшения количества дней с симптомами ОРВИ прием LGG приводил к снижению риска развития ОРВИ у детей в исследовании М. Kumpu et al. (2015)8.
Прием LGG у детей пониженного питания приводил к уменьшению заболеваемости кишечными инфекциями, инфекциями верхних дыхательных путей, снижению частоты случаев инфекции мочевыводящих путей, а к концу лечения – к уменьшению частоты госпитализаций9.
Согласно исследованию J. Mirpuri et al. (2012) прием Lactobacillus rhamnosus LGG в течение 2 недель сопровождался снижением продукции ИФН-γ и IL-2, а также IL-4 периферическими Т-лимфоцитами (рис. 2). Изменение регулируемого дендритными клетками баланса адаптивного иммунитета сопровождается снижением провоспалительного ответа (Th1, Th12)10. Стимулирующее воздействие на дендритные клетки кишечника, отвечающие за образование Tr-клеток и выработку IL-10, способствует иммуномодуляции11.
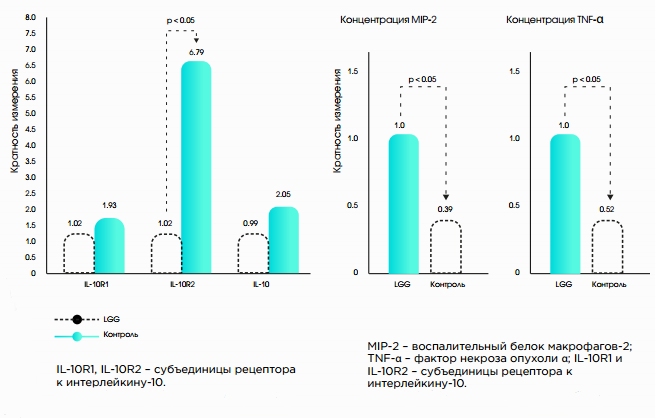
Рис. 2.
Бифиформ Кидс – комбинированное пробиотическое лекарственное средство, содержащее наиболее изученные и безопасные штаммы (Lactobacillus rhamnosus LGG + Bifidobacterium animalis subsp. lactis BB-12 )12,13, дополненное витаминами (B1+B6)14. Лактобактерии (LGG) и бифидобактерии (ВВ-12), синергически взаимодействуя, поддерживают и регулируют физиологическое равновесие кишечной микрофлоры, повышая устойчивость слизистой оболочки кишечника к болезнетворным микроорганизмам; ингибируют транслокацию патогенных бактерий в толстой кишке, обладают антагонистической активностью в отношении многих патогенных и условно-патогенных микроорганизмов, нормализуют показатели иммунитета при его угнетении14.
Таким образом, можно говорить о наступлении «эпохи Возрождения» микробиоты человека с появлением таких препаратов, как Бифиформ Кидс.
Список литературы:
















