Нутритивная поддержка организма при стрессе в эпоху глобальных вызовов человечеству
|
Авторы С.В. Орлова1, Е.А. Никитина1, Н.В. Балашова1, И.В. Подопригора1, О.Е. Пронина2 1. ФГАОУ ВО «Российский университет дружбы народов», Москва. Резюме Перенесенная коронавирусная инфекция вызывает стресс и отрицательно влияет на психоэмоциональное здоровье людей. Коронавирус способен проникать в центральную нервную систему, поражая нейроны и глиальные (вспомогательные) клетки. Проявляется это резкими перепадами настроения, низким самоконтролем поведения, паническими атаками. Питание является важным определяющим фактором иммунного и неврологического статуса человека. При этом недостаточное содержание микронутриентов в рационе питания является самым распространенным преморбидным фоном для развития патологических процессов. Во всем мире отмечается невозможность компенсации витаминов и минералов традиционными пищевыми продуктами. Может быть целесообразным прием витаминно-минеральных и аминокислотных комплексов, отдельных минорных веществ. Другие нутриенты, такие как Омега-3 полиненасыщенные жирные кислоты, также поддерживают эффективную работу иммунной и нервной систем, оказывая противовоспалительные эффекты. Ключевые слова: коронавирус, постковидный синдром, стресс, питание, витамины, минералы, микронутриенты, минорные вещества, Омега-3 полиненасыщенные жирные кислоты. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Публикация выполнена при поддержке Программы стратегического академического лидерства РУДН. |
|
Authors S.V. Orlova1, E.A. Nikitina1, N.V. Balashova1, I.V. Podoprigora1, O.E. Pronina2 1. Russian University of Peoples' Friendship, Moscow, Russia. Summary The transferred coronavirus infection causes stress and negatively affects the psycho-emotional health of people. Coronavirus is able to penetrate the central nervous system, affecting neurons and glial (auxiliary) cells. This is manifested by sudden mood swings, low self-control of behavior, panic attacks. Nutrition is an important determinant of the immune and neurological status of a person, while the insufficient content of micronutrients in the diet is the most common premorbid background for the development of pathological processes. All over the world, it is noted that it is impossible to compensate for vitamins and minerals with traditional foods. It may be appropriate to take vitamin-mineral and amino acid complexes, individual minor substances. Other nutrients, such as omega-3 fatty acids, also support the efficient functioning of the immune and nervous systems by providing anti-inflammatory effects. Key words: coronavirus, post-COVID syndrome, stress, nutrition, vitamins, minerals, micronutrients, minor substances, omega-3 polyunsaturated fatty acids. Conflict of interests. The authors declare no conflict of interest. The publication was made with the support of the RUDN University Strategic Academic Leadership Program.
|
Введение
Современный мир в настоящее время столкнулся со множеством глобальных вызовов, оказывающих прямое влияние на состояние здоровья человека [1]. В декабре 2019 г. население планеты столкнулось с ранее неизученной вирусной инфекцией SARS-CoV-2, перешедшей в масштабы мировой пандемии [2].
Для каждого человека период эпидемии стал сильным стрессовым фактором, повлекшим за собой внезапное изменение привычного образа жизни. С целью борьбы с распространением инфекции были предприняты различные шаги, в том числе меры по социальному дистанцированию. Для выполнения этих мер были введены строгий режим самоизоляции и карантин. Эффект этих радикальных мер и обязательных ограничений сказался на психологических, физических, пищевых и экономических аспектах жизни людей. Последствия карантина привели к выраженному снижению мотивационных механизмов, формированию негативных психологических установок и увеличению числа психосоматических состояний. Согласно исследованию, проведенному в Китае, почти 35% населения испытывали психологический стресс в период локдауна [3]. Кроме того, снижалась физическая активность, приводя к малоподвижному образу жизни [4].
Перенесенное заболевание оказало серьезное влияние на физическое здоровье пациентов. В МКБ-10 (код U09.9.) введена новая нозология «Состояние после COVID-19 (постковидный синдром) у взрослых». На практике «постковидный синдром», или синдром постковидных нарушений (СПКН), — это зонтичный термин для комплекса персистирующих симптомов, развивающихся у пациента после перенесенного COVID-19, и обозначает проблемы со здоровьем, оставшиеся по прошествии четырех и более недель после перенесенного острого заболевания, которых до коронавируса не было. Исследование, проведенное в Испании, с участием пациентов, перенесших COVID-19, показало высокую частоту остаточных явлений (~50%) через 10—14 недель после начала заболевания. Согласно результатам исследования, в основном преобладали нетяжелые клинические симптомы: общая слабость, утомляемость, одышка, неврологические жалобы. Рентгенологические и спирометрические изменения при этом наблюдались менее чем у 25% обследованных. СПКН также был ассоциирован с высоким уровнем стресса, оцениваемым по специальным опросникам, и снижением качества жизни [5].
Доступные данные о частоте и клиническом течении СПКН немногочисленны и разнородны. В ряде исследований [6—8] использовали метод структурированного телефонного интервью. S. Halpin и соавт. провели опрос в среднем через 48 дней после выписки из больницы 100 пациентов, из них 32 проходили лечение в отделении интенсивной терапии [9]. Наиболее частым симптомом у респондентов оказалась общая слабость (встречалась в 60,3% случаев в общей группе и у 72% пациентов после терапии в реанимационном отделении), за ней следовали одышка (в 42,6 и 65,6% случаев соответственно), психологический стресс (в 23,5 и 46,9% случаев соответственно), снижение качества жизни по данным опросника EQ5D (у 45,6 и 68,8% опрошенных соответственно) [6].
Помимо воздействия на физическое здоровье, пост-COVID-19-синдром также влияет на психологическое состояние, включая развитие тревоги, депрессии, посттравматического стрессового расстройства и когнитивных нарушений, которые часто являются побочными продуктами экономических проблем или усложняющих факторов, особенно при длительном течении COVID-19 [10]. Большинство людей, перенесших коронавирусную инфекцию, переживают стрессовое состояние, часто переходящее впоследствии в хроническую форму, что позволяет говорить о так называемом посткоронавирусном синдроме. По данным британских исследователей, этот синдром затрагивает до 10% населения Земли, подвергшегося сочетанию психосоциальных и биологических факторов стресс-уязвимости [11]. Новая болезнь вызвала смятение, панику и хаос, которые предсказуемо привели к стрессовым реакциям [12].
В практической психологии все чаще используется термин «синдром COVID-стресса» (СOVID stress syndrome), так как большинство переболевших в популяции впоследствии переживали острое стрессовое расстройство, многие сталкивались с посттравматическим стрессовым расстройством, у 10% диагностированы затяжные тревожные расстройства, невротические нарушения, депрессивные эпизоды, личностные деформации [13].
Недавние исследования показали, что значительная часть пациентов с COVID-19 страдает синдромом усталости после перенесенного COVID-19 с симптомами, напоминающими синдром хронической усталости (СХУ) [14]. Патофизиология СПКН сложна и включает в себя вегетативную дисфункцию, эндокринные нарушения и реактивные расстройства настроения (например, депрессию или тревогу) в сочетании с генетической, экологической и социально-экономической предрасположенностью [14].
В процессе воздействия стресса на организм активируются прежде всего вегетативная и эндокринная системы, запускающие каскад реакций: выброс катехоламинов в кровоток приводит к симпатической активации, для обеспечения энергетического депо мобилизуется депонированная глюкоза и жирные кислоты, снижается эффективность иммунной системы, изменяется работа внутренних органов за счет перераспределения кровотока с доминирующим вектором к мышцам и мозгу.
Хроническое течение стресса приводит к сбою механизмов саморегуляции: нарушению биоритмов, подавлению неспецифических защитных реакций, иммунной супрессии.
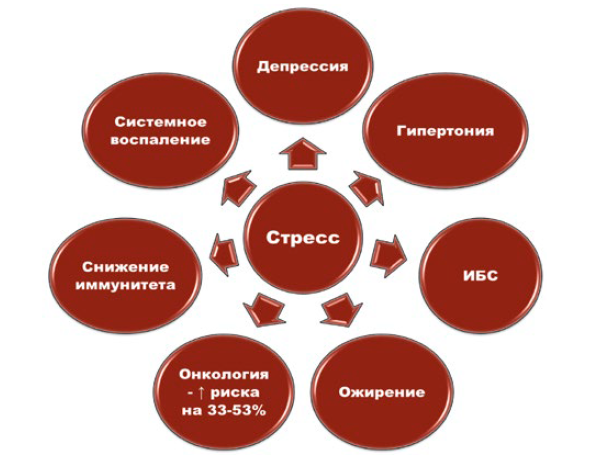
Рисунок 1. Стресс как фактор риска развития некоторых неинфекционных алиментарно-зависимых патологий
Данный неблагоприятный фон является отягощающим для течения любого соматического заболевания [15].
Нутритивный статус и стресс
В последние годы все больше внимания уделяется связи между рационом питания, отдельными микронутриентами и состоянием физического и психического здоровья человека.
Многочисленными научными исследованиями установлено, что большое количество нутриентов может оказывать комплексное воздействие на функции разных органов и систем организма за счет независимых и синергетических механизмов, поэтому питание может сыграть ключевую роль в лечении и реабилитации СПКН синдрома после COVID-19 [16].
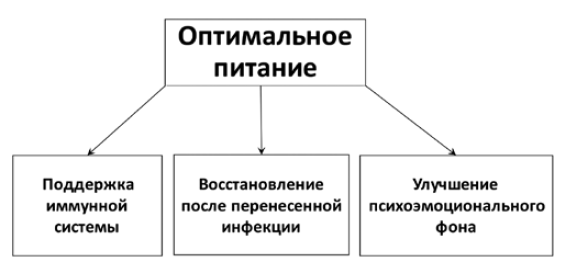
Рисунок 2. Влияние оптимального питания на поддержку иммунной системы, улучшение психоэмоционального фона и реабилитацию после перенесенной инфекции
Оптимальное питание регулирует нейрогуморальную систему посредством модификации сигнальных молекул, влияя на активность клеток и экспрессию генов. Различные нутриенты влияют на баланс микробиоты кишечника и функционирование оси «кишечник-мозг».
COVID-19 изменил частоту и набор потребляемых человеком продуктов [17, 18.]. Эти изменения подтвердили гипотезу о том, что пребывание дома и социальное дистанцирование оказывают негативное влияние на приверженность принципам здорового питания [17]. В частности, в Испании сообщалось, что рацион питания людей во время изоляции имел бо́льшую энергетическую ценность на 539 ккал, количественный и качественный дисбаланс, чем до COVID-19 [19]. По сравнению с аналогичным периодом 2019 года возросло потребление растительной пищи, такой как орехи, макароны, рис или обработанные овощи, немного увеличилось потребление яиц и красного мяса, но снизилось потребление жидкости [18]. Потребление красного мяса превышало рекомендуемые диетические рекомендации, в то время как употребление продуктов растительного происхождения оставалось ниже рекомендуемого диапазона [18].
Исследование, проведенное среди населения Польши, показало, что во время изоляции люди ели и перекусывали чаще и больше по объему, причем эти тенденции чаще встречались у людей с избыточной массой тела и ожирением [20]. Одна из возможных причин увеличения потребления энергии и тяга к высококалорийной пище могла быть связана с длительным пребыванием дома, однообразием жизни, удаленной работой и стрессом [21]. Модель питания китайцев во время изоляции из-за COVID-19 также изменилась, продемонстрировав снижение частоты потребления свежих овощей и фруктов, риса, птицы, мяса и соевых продуктов [22].
Примечательно, что при карантине во всех странах у людей с избыточной массой тела и ожирением отмечалось наиболее выраженное нарушение рациона питания, образа жизни и более разрушительное пищевое поведение, включающее частые перекусы, переедание и потребление пищи без чувства голода [23, 24]. Кроме того, они реже потребляли фрукты, овощи и бобовые во время изоляции и чаще потребляли молочные продукты, мясо и фаст-фуд [24]. Локдаун также привел к изменению моделей питания детей и подростков с ожирением, значительно увеличив потребление ими картофельных чипсов, сладких напитков и красного мяса по сравнению с тем же периодом в 2019 году [25]. Изменения рациона питания и пищевого поведения привели к значительному увеличению общей и жировой массы тела [26] и могут в долгосрочной перспективе увеличивать риск развития алиментарно-зависимых заболеваний [27—30]. Необходимо учитывать, что нездоровые привычки в еде на фоне негативных эмоций, изоляции и стресса имеют тенденцию к закреплению.
Нутритивная поддержка человека при СПКН
Оптимальное и сбалансированное питание является неотъемлемой частью стратегии управления личным риском во время пандемии COVID-19 [31] из-за иммуномодулирующих и антистрессовых эффектов, которые оказывают комплексные пищевые паттерны, а также некоторые макро-, микро- и фитонутриенты [32].
Эпидемиологические исследования показали, что средиземноморская диета, связанная с высоким потреблением фруктов и овощей [33], может уменьшить маркеры воспаления и снизить риск развития депрессии. Напротив, воздействие диеты с высоким гликемическим индексом и богатой рафинированными углеводами увеличивает возникновение депрессивных симптомов [34]. Высокое потребление насыщенных и трансжиров может привести к снижению когнитивных функций и дисфункции гиппокампа, что приводит к нарушению психологического благополучия [35].
Установлено, что целый ряд микронутриентов обладает защитным эффектом для мозга [36]: липиды в виде Омега-3 жирных кислот (эйкозапентаеновая, докозагексаеновая, линолевая α-липоевая кислоты), витамины (C, B9, D3 и E), растительные полифенолы (флавоны: апигенин и лютеолин; флавонолы: тангеретин, хризин, кверцетин и дигидрокверцетин; изофлавоны: нарингенин, нарингин, геспередин, рутин; антоцианидины, фенольные кислоты, стильбен, теофиллин, капсаицин, пиперин, микроэлементы и эндогенные антиоксиданты: цинк, селен, глутатион, мелатонин, креатин и N-ацетилцистеин).
Проникновение нутриентов через гематоэнцефалический барьер может оказывать потенциальное защитное действие на нейроны и эндотелий сосудов головного мозга [37]. Нейропротекторные эффекты микронутриентов и биологически активных веществ лекарственных растений были продемонстрированы как во многих доклинических экспериментах, так и в клинических исследованиях [38].
Существуют данные, подтверждающие, что дефицит некоторых микронутриентов (например, витамина С, группы витаминов В, натрия, магния, цинка, фолиевой кислоты, L-карнитина, L-триптофана, незаменимых жирных кислот и коэнзима Q10) играет важную роль в течении и прогрессировании симптомов СПКН [39]. Экспертная группа Европейского агентства по безопасности продуктов питания (EFSA) выделила витамины и минералы, необходимые для повышения иммунитета и устойчивости к стрессу. В рекомендации вошли шесть витаминов — D, С, А, В6, фолат и В12, а также четыре минерала — цинк, железо, медь и селен [40].
Исследования показывают, что острый и хронический психологический стресс связан с повышенной воспалительной активностью в организме, что способствует возникновению неблагоприятных симптомов психического здоровья [41]. Противовоспалительные свойства ПНЖК, фитонутриентов и антиоксидантов могут принести непосредственную пользу.
Омега-3 ПНЖК. Хорошо известно, что данные вещества оказывают благоприятное воздействие на иммунитет и блокируют воспалительный процесс, т. к. ω-3 ПНЖК запускает продукцию провоспалительных цитокинов, способствующих секреции кортикотропин-рилизинг фактора — главного гормона, запускающего нейроэндокринный ответ на стресс, уменьшая симптомы тревоги. Исследования показывают, что полиненасыщенные жирные кислоты Омега-3 защищают от депрессии и уменьшают симптомы депрессии [42, 43].
Кроме того, стоит отметить, что липиды составляют примерно 50—70% сухой массы мозга, а изменения в липидной среде мозга приводят к функциональным изменениям активности рецепторов и других мембранных белков, влияя на нейротрансмиссию [44]. Было продемонстрировано, что диеты, богатые Омега-3 жирными кислотами, активизируют гены, участвующие в поддержании синаптической функции и пластичности у животных и улучшении когнитивных функций у людей [45]. Кроме того, дефицит Омега-3 жирных кислот связан с повышенным риском развития различных психических расстройств, а их нормальное содержание важно для поддержания психологического благополучия [44].
В РКИ 2018 года оценивали добавки Омега-3 в качестве адъювантной терапии к стандартным антидепрессантам у пациентов с большими депрессивными расстройствами. После 12-недельного лечения, по сравнению с плацебо, участники группы лечения Омега-3 сообщали о меньшем количестве симптомов депрессии, чувствительности к тревоге и нарушениях сна, а также об улучшении регуляции своих эмоций [46].
Витамин С принимает участие в обмене глутамата и катехоламинов, уменьшает стресс-опосредованное высвобождение кортизола. В дозе 0,5—3 г/д аскорбиновая кислота оказывает антидепрессивное, анксиолитическое действие, снижает стресс-индуцированный подъем артериального давления, в том числе у госпитализированных пациентов (сильнее, чем витамин D) [47, 48]
Каротиноиды. В РКИ 2018 года оценивалось влияние каротиноидов (13 или 27 мг в день) на 59 молодых здоровых участников. Было обнаружено, что потребление каротиноидов снижает психологический стресс и улучшает эмоциональное и физическое здоровье по сравнению с плацебо [49].
Антиоксиданты. Другие антиоксиданты, такие как витамины A и E, также могут играть роль в развитии и облегчении тревожных и депрессивных симптомов. Обсервационное исследование 80 пациентов показало, что у людей с генерализованным тревожным расстройством исходный уровень этих витаминов в сыворотке крови был ниже по сравнению со здоровыми людьми из контрольной группы [50]. После 6-недельного лечения витаминами А, С и Е [51] сообщалось о значительном повышении уровня антиоксидантов в крови и значительном снижении тревоги и депрессии [50].
Витамин D. Метаанализ 25 исследований, в котором приняло участие 7534 человека, показал, что витамин D оказывает влияние на негативные эмоции (g Хеджеса = -0,4990, 95% ДИ [-0,8453, -0,1528], p = 0,0047, I 2 = 97,7%). Эффект наиболее выражен у пациентов с большим депрессивным расстройством, при тревоге, в возрасте 18—65 лет и у людей с недостаточностью витамина D (25(OH) D ≤20 нг/мл). Дополнительный прием витамина D оказывал положительный эффект на настроение при приеме в дозе до 4000 МЕ/д и прием не менее 8 недель [52].
Витамины группы В. Эти витамины необходимы для репаративных процессов и поддержки нервной системы [53]. Метаанализ 10 исследований, включавших в общей сложности 958 человек, показал, что прием витаминов группы В способствовал уменьшению симптомов стресса (SMD = 0,23, 95% ДИ = 0,02, 0,45, p = 0,03) [54].
Витаминно-минеральные комплексы. Доказано, что прием ВМК мужчинами в возрасте 30—55 лет уменьшает ощущение стресса, повышает настроение, придает ощущение бодрости, улучшает когнитивные функции при интенсивной умственной нагрузке [55]. У женщин старше 50 лет прием ВМК улучшает настроение и снижает выраженность психического стресса при выполнении тестов [56]. Еще одно исследование было проведено на 242 здоровых добровольцах в возрасте 38,6 ± 13,6 лет, (79,8% из которых были женщины) находящихся в состоянии психологического стресса. Прием витаминно-минерального комплекса в сочетании с пробиотиками L. gasseri, B. bifidum, B. longum способствовал снижению психологического стресса на 22,7 % (с 34,1 ± 4,5 до 26,2 ± 6,1 балла по шкале воспринимаемого стресса (PSS 10), P <0,0001), утомляемости — на 45,0% (с 16,8 ± 6,4 до 8,7 ± 6,2, P <0,0001). Эффект сохранялся через месяц после отмены комплекса [57].
Магний. Одним из наиболее важных нутриентов, повышающих адаптационные резервы организма, в связи с выраженным антистрессовым эффектом является магний. Магний улучшает нейротрансмиссию и снижает хроническое воспаление [58].
Дефицит магния приводит к сверхвозбудимости клетки вследствие нарушения как минимум 3 типов белков: NMDA-рецепторов, катехол-О-метилтрансферазы и аденилат циклаз. Адренергические эффекты стресса индуцируют переход магния во внеклеточное пространство, выведение элемента из депо и магнеурию, что формирует выраженные дефициты.
Нутритивная коррекция рациона питания магнием стабилизирует работу гипоталамо-гипофизарно-надпочечниковой оси, купируя психологические проявления стресса (волнение, раздражительность, тревожность, депрессивные расстройства [59]).
Одно из проведенных исследований показало, что прием магния способствует уменьшению стресса: усталости, раздражительности, проблем сна [60]. Так, ежедневный прием 300 мг магния и 30 мг витамина B6 способствовал уменьшению стресса, особенно у людей с исходно тяжелым уровнем стресса, со снижением баллов по шкале депрессии, тревожности и стресса (DASS-42) до 45% от исходного уровня [61].
Магнийсодержащие биодобавки можно рекомендовать для повышения устойчивости организма к стрессу, а также с целью снижения риска сердечно-сосудистых осложнений за счет свойства магния противодействовать экзотоксичности клеток и обезвреживать избыток гомоцистеина [62].
Одними из наиболее перспективных соединений магния в клинической практике являются хелаты (греч. chele — клешня) — соединения, образовывающие стойкие малодиссоциирующие комплексы с металлами, легкорастворимые в воде. Биоусвояемость минералов происходит в тонком кишечнике путем активного транспорта с присоединением свободного иона металла к транспортному белку, позволяющему переносить его в кровоток [63]. Биодоступность магния в хелатной форме достигает 80—90% [64], в то время как неорганические соединения усваиваются не более 2—20% [63].
Магния бисглицинат представляет собой комплекс минерала и глицина. Глицин — незаменимая аминокислота, выполняющая важные нейротрансмиттерные функции в головном мозге. В составе соединения с магнием она проявляет дополнительный успокаивающий эффект. Предварительные исследования также показывают, что глицинат магния может повышать уровень магния в тканях головного мозга [65].
Цинк. РДСПКИ исследовало 30 женщин, которые получали мультивитаминный комплекс с или без 7 мг цинка ежедневно в течение 10 недель. Женщины, которые принимали ВМК с цинком, продемонстрировали значительное снижение показателей гнева-враждебности (P = 0,009) и депрессии-подавленности (P = 0,011), тогда как у женщин, которые принимали только витамины, улучшения настроения не происходило [66]. Установлено, что риск развития депрессии на 33% ниже у тех, кто потребляет максимальное количество цинка с пищей на 33% (ОР 0,67, 95% ДИ: 0,58-0,76) и соответственно [67]. Другое исследование показало, что дополнительный прием цинка повышает эффективность антидепрессантов у пациентов с клинической депрессией [68].
Железо. Более низкий уровень железа связан с депрессивным настроением, функциональной усталостью и ухудшением памяти, в том числе у пожилых людей [69]. Установлено, что риск развития депрессии на 43% ниже у тех, кто потребляет максимальное количество железа с пищей (ОР 0,57, 95% ДИ: 0,34—0,95) [69].
Куркумин. Куркумин представляет собой смесь трех основных диарил гептаноидов: 75—77% составляет куркумин (диферулоилметан), 15—18% — деметоксикуркумин, 5—7% — бис-деметоксикуркумин. По химической структуре куркумин представляет собой бис- α-, β-ненасыщенный β-дикетон, образующийся в результате конъюгации двух молекул феруловой кислоты, соединенных посредством метиленового мостика [70].
В ряде исследований куркумин показал способность модулировать концентрации нейротрансмиттеров, нейропластичность, гипоталамо-гипофизарно-надпочечниковые нарушения, окислительный и нитрозативный стресс и эндоканнабиноидную систему, все из которых могут быть вовлечены в патофизиологию депрессии [71]. 12-недельное РКИ в 2018 году специально изучало куркумин и обнаружило, что увеличение дозы (с 500 до 1500 мг/день) в качестве дополнительного лечения большого депрессивного расстройства оказывает значительное антидепрессивное действие [72]. Другое 12-недельное РКИ в 2017 году с аналогичными дозами куркумина также показало аналогичные эффекты, улучшающие симптомы депрессии, а также снижающие тревогу у взрослых с депрессией [73].
Плохая растворимость в воде, биодоступность и фармакокинетические профили ограничивают терапевтическое использование куркумина, т. к. усваивается лишь на 5—10%. Для повышения биодоступности при производстве капсул экстракт куркумина покрывают мицеллярной оболочкой, представляющей собой «гидрофильные» микросферы. Мицеллы меняют процесс абсорбции и дают возможность куркумину легче проникать в кровоток [74].
Пробиотики. Кишечная микробиота занимает одну из главных ролей в генезе хронического стресса, особенно на фоне перенесенного ранее инфекционного процесса [75]. У пациентов с COVID-19 выявлены изменения в составе кишечной микробиоты, особенно в контексте применения антибиотиков, и это может иметь как краткосрочные, так и долгосрочные последствия для физического и психологического благополучия, включая выздоровление и возникновение/тяжесть пост-COVID-19 синдрома [76]. После перенесенной инфекции COVID-19 происходит изменение состава и разнообразия микробиоты кишечника, которое сохраняется на протяжении 6 месяцев: снижается концентрация лакто- и бифидобактерий и повышается численность условно-патогенных микроорганизмов [77, 78].
Микробиом участвует в производстве широкого спектра важных соединений: короткоцепочечных жирных кислот (КЦЖК) [79], нейромедиаторов, цитокинов, нейропептидов. Кишечник может связываться с мозгом с помощью нервных, воспалительных и гормональных сигнальных путей, что влияет на психологическое благополучие [80]. Снижение КЦЖК приводит к увеличению грамотрицательных микробов и, как следствие, содержанию липополисахаридов — эндотоксинов, индуцирующих ряд патологических реакций, усугубляющих течение стресса.
Пробиотики улучшают психологические или физиологические показатели депрессии, тревоги или стресса у людей, предрасположенных к нарушениям настроения. Отдельные штаммы пробиотиков снижают концентрацию кортизола у здоровых людей. Добавление к пробиотикам ФОС и ГОС повышает количество бифидобактерий, уменьшает выраженность тревоги и депрессии при употреблении ≥ 5 г/д [81].
Установлено, что L. plantarum DR7 оказывает влияние на обмен дофамина и серотонина, за счет чего осуществляется анксиолитическое и антистрессорное действие. Исследования показали, что прием пробиотика с Lactobacillus plantarum DR7 снижает концентрацию кортизола, уменьшает ощущение стресса и тревоги. В подгруппе людей старше 30 лет улучшает отдельные показатели памяти и когнитивные способности у людей, находящихся в состоянии стресса, а также уменьшает частоту дефекации при психогенной диарее [82, 83].
Заключение
Таким образом, сбалансированный рацион питания, богатый фруктами, овощами, Омега-3 жирными кислотами, с низким потреблением трансжиров и рафинированных углеводов может улучшить психологическое благополучие и помочь в контроле/облегчении пост-COVID-19 синдрома.
Принимая во внимание повышенную потребность организма в важных нутриентах в постковидный период для нивелирования стресс-связанных последствий, целесообразно осуществлять превентивные меры в виде назначения нутритивной поддержки на период до 6 месяцев после перенесенной коронавирусной инфекции.
В период реабилитации после COVID-19 международные группы ученых рекомендуют принимать биодобавки к пище, содержащие основные микронутриенты, играющие важную роль в комплексной реабилитации пациентов с коронавирусной инфекцией COVID-19.
Список литературы / References
1. Dong E, Du H, Gardner L. An interactive web-based dashboard to track COVID-19 in real time. Lancet Inf. Dis. 20(5):533- doi: 10.1016/S1473-3099(20)30120-1.
2. Coronavirus disease 2019 (COVID-19). World Health Organization Situation Report. (Электронный ресурс). URL: https://www.who.int/ docs/default-source/coronaviruse/situation-reports/20200305-sitrep-45-covid-19.pdf (2022).
3. Ahorsu DK, Lin CY, Imani V, Saffari M, Griffiths MD, Pakpour AH. The fear of COVID-19 scale: Development and initial validation Int J. Ment. Health. Addict. 2020 1-9. doi:10.1007/s11469-020-00270-8.
4. Bas D, Martin M, Pollack C, Venne R. The impact of COVID-19 on sport, physical activity and well-being and its effects on social development Division for Inclusive Social Development in UN DESA. Policy Brief 73, 2020.
5. Moreno-Pérez O, Merino E, Leon-Ramirez JM, Andres M, Ramos JM, Arenas-Jiménez J, Asensio S, Sanchez R, Ruiz-Torregrosa P, Galan I, Scholz A, Amo A, González-delaAleja P, Boix V, Gil J. COVID19-ALC research group. Post-acute COVID-19 syndrome. Incidence and risk factors: A Mediterranean cohort study. J. Infect. 2021 Mar;82(3):378- doi: 10.1016/j.jinf.2021.01.004.
6. Halpin SJ, McIvor C, Whyatt G, Adams A, Harvey O, McLean L, Walshaw C, Kemp S, Corrado J, Singh R, Collins T, O'Connor RJ, Sivan M. Postdischarge symptoms and rehabilitation needs in survivors of COVID-19 infection: A cross-sectional evaluation. J. Med. Virol. 2021 Feb;93(2):1013- doi: 10.1002/jmv.26368.
7. Tenforde MW, Kim SS, Lindsell CJ, Billig Rose E, Shapiro NI, Files DC, Gibbs KW, Erickson HL, Steingrub JS, Smithline HA, Gong MN, Aboodi MS, Exline MC, Henning DJ, Wilson JG, Khan A, Qadir N, Brown SM, Peltan ID, Rice TW, Hager DN, Ginde AA, Stubblefield WB, Patel MM, Self WH, Feldstein LR. IVY Network Investigators; CDC COVID-19 Response Team; IVY Network Investigators. Symptom Duration and Risk Factors for Delayed Return to Usual Health Among Outpatients with COVID-19 in a Multistate Health Care Systems Network — United States, March-June 2020. MMWR Morb Mortal Wkly Rep. 2020 Jul 31;69(30):993-998. doi: 10.15585/mmwr.mm6930e1.
8. Carvalho-Schneider C., Laurent E., Lemaignen A., Beaufi ls E., Bourbao-Tournois C., Laribi S. et al. Follow-up of adults with non-critical COVID-19 two months after symptoms’ onset // Clin.Microbiol. Infect. 2021;27(2):258-263. DOI: https://doi. org/10.1016/j.cmi.2020.09.052.
9. Halpin S.J., McIvor C., Whyatt G., Adams A., Harvey O., McLean L. et al. Postdischarge symptoms and rehabilitation needs in survivors of COVID-19 infection: a cross-sectional evaluation // J. Med. Virol. 2021;93(2):1013- DOI: https://doi.org/10.1002/jmv.26368.
10. Shanbehzadeh S, Tavahomi M, Zanjari N, Ebrahimi-Takamjani I, Amiri-Arimi S. Physical and mental health complications post-COVID-19: Scoping review. J. Psychosom Res. 2021 Aug;147:110525. doi: 10.1016/j.jpsychores.2021.110525.
11. National Collaborating Centre for Mental Health (UK). Post-traumatic stress disorder. (NICE Clinical Guidelines, No. 116). URL: https://www.nice.org.uk/guidance /ng116/resources/posttraumatic-stress-disorder-pdf-66141601777861 Under Creative Commons License: Attribution, 2020.
12. Акарачкова Е.С., Беляев А.А., Кадырова Л.Р. и др. Стресс и питание. РМЖ. Медицинское обозрение. 2021;5(5):316-321 (in Russ.). DOI: 10.32364/2587-6821-2021-5-5-316-321
Akarachkova E.S., Belyaev A.A., Kadyrova L.R. et al. Stress and nutrition. Russian Medical Inquiry. 2021;5(5):316-321 (in Russ.). DOI: 10.32364/2587-6821-2021-5-5-316-321.
13. Белопасов В.В., Журавлева Е.Н., Нугманова Н.П., Абдрашитова А.Т. Постковидные неврологические синдромы // Клиническая практика. 2021;12(2):69-82. doi: 10.17816/clinpract71137.
Belopasov V.V., Zhuravleva E.N., Nugmanova N.P., Abdrashitova A.T. Post-covid-19 neurological syndromes. J. of Clinical Practice. 2021;12(2):69-82 (in Russ.). doi: 10.17816/clinpract71137.
14. Sandler CX, Wyller VBB, Moss-Morris R, Buchwald D, Crawley E, Hautvast J, Katz BZ, Knoop H, Little P, Taylor R, Wensaas KA, Lloyd AR. Long COVID and Post-infective Fatigue Syndrome: A Review. Open Forum Infect Dis. 2021 Sep 9;8(10):ofab440. doi: 10.1093/ofid/ofab440.
15. Blanc-Lapierre A, Rousseau MC, Weiss D, El-Zein M, Siemiatycki J, Parent MÉ. Lifetime report of perceived stress at work and cancer among men: A case-control study in Montreal, Canada. Prev. Med. 2017 Mar;96:28- doi: 10.1016/j.ypmed.2016.12.004.
16. Stachowska E, Folwarski M, Jamioł-Milc D, Maciejewska D, Skonieczna-Żydecka K. Nutritional Support in Coronavirus 2019 Disease. Medicina (Kaunas). 2020 Jun 12;56(6):289. doi: 10.3390/medicina56060289.
17. Rundle AG, Park Y, Herbstman JB, Kinsey EW, Wang YC. COVID-19-Related School Closings and Risk of Weight Gain Among Children. Obesity (Silver Spring). 2020 Jun;28(6):1008- doi: 10.1002/oby.22813.
18. Rodriguez-Besteiro S, Tornero-Aguilera JF, Fernández-Lucas J, Clemente-Suárez VJ. Gender Differences in the COVID-19 Pandemic Risk Perception, Psychology, and Behaviors of Spanish University Students. Int. J. Environ. Res. Public. Health. 2021 Apr 8;18(8):3908. doi: 10.3390/ijerph18083908.
19. Batlle-Bayer L., Aldaco R., Bala A., Puig R., Laso J., Margallo M., Vázquez-Rowe I., Antó J.M., Fullana-i-Palmer P. Environmental and nutritional impacts of dietary changes in Spain during the COVID-19 lockdown. Sci. Total Environ. 2020, 748.
20. Sidor A, Rzymski P. Dietary Choices and Habits during COVID-19 Lockdown: Experience from Poland. Nutrients. 2020 Jun 3;12(6):1657. doi: 10.3390/nu12061657.
21. Muscogiuri G, Barrea L, Savastano S, Colao A. Nutritional recommendations for CoVID-19 quarantine. Eur. J. Clin. Nutr. 2020 Jun;74(6):850- doi: 10.1038/s41430-020-0635-2.
22. Jia P, Liu L, Xie X, Yuan C, Chen H, Guo B, Zhou J, Yang S. Changes in dietary patterns among youths in China during COVID-19 epidemic: The COVID-19 impact on lifestyle change survey (COINLICS). Appetite. 2021 Mar 1;158:105015. doi: 10.1016/j.appet.2020.105015.
23. Opichka K, Smith C, Levine AS. Problematic Eating Behaviors Are More Prevalent in African American Women Who Are Overweight or Obese Than African American Women Who Are Lean or Normal Weight. Fam Community Health. 2019 Apr/Jun;42(2):81-89. doi: 10.1097/FCH.0000000000000222.
24. Błaszczyk-Bębenek E, Jagielski P, Bolesławska I, Jagielska A, Nitsch-Osuch A, Kawalec P. Nutrition Behaviors in Polish Adults before and during COVID-19 Lockdown. Nutrients. 2020 Oct 10;12(10):3084. doi: 10.3390/nu12103084.
25. Pietrobelli A, Pecoraro L, Ferruzzi A, Heo M, Faith M, Zoller T, Antoniazzi F, Piacentini G, Fearnbach SN, Heymsfield SB. Effects of COVID-19 Lockdown on Lifestyle Behaviors in Children with Obesity Living in Verona, Italy: A Longitudinal Study. Obesity (Silver Spring). 2020 Aug;28(8):1382-1385. doi: 10.1002/oby.22861.
26. Larsen SC, Heitmann BL. More Frequent Intake of Regular Meals and Less Frequent Snacking Are Weakly Associated with Lower Long-Term Gains in Body Mass Index and Fat Mass in Middle-Aged Men and Women. J. Nutr. 2019 May 1;149(5):824- doi: 10.1093/jn/nxy326.
27. Serra-Majem L, Tomaino L, Dernini S, Berry EM, Lairon D, Ngo de la Cruz J, Bach-Faig A, Donini LM, Medina FX, Belahsen R, Piscopo S, Capone R, Aranceta-Bartrina J, La Vecchia C, Trichopoulou A. Updating the Mediterranean Diet Pyramid towards Sustainability: Focus on Environmental Concerns. Int. J. Environ Res. Public. Health. 2020 Nov 25;17(23):8758. doi: 10.3390/ijerph17238758.
28. Poobalan AS, Aucott LS, Clarke A, Smith WC. Diet behaviour among young people in transition to adulthood (18-25 year olds): a mixed method study. Health Psychol Behav Med. 2014 Jan 1;2(1):909- doi: 10.1080/21642850.2014.931232.
29. Araiza AM, Lobel M. Teaching & learning guide for: Stress and eating: Definitions, findings, explanations, and implications. Soc Personal Psychol Compass. 2018; 12:e12391. https://doi.org/10.1111/spc3.12391.
30. Moynihan AB, van Tilburg WA, Igou ER, Wisman A, Donnelly AE, Mulcaire JB. Eaten up by boredom: consuming food to escape awareness of the bored self. Front Psychol. 2015 Apr 1;6:369. doi: 10.3389/fpsyg.2015.00369.
31. Gasmi A, Noor S, Tippairote T, Dadar M, Menzel A, Bjørklund G. Individual risk management strategy and potential therapeutic options for the COVID-19 pandemic. Clin. Immunol. 2020 Jun;215:108409. doi: 10.1016/j.clim.2020.108409.
32. Fernandez ML, Raheem D, Ramos F, Carrascosa C, Saraiva A, Raposo A. Highlights of Current Dietary Guidelines in Five Continents. Int J Environ Res Public Health. 2021 Mar 10;18(6):2814. doi: 10.3390/ijerph18062814.
33. Lassale C, Batty GD, Baghdadli A, Jacka F, Sánchez-Villegas A, Kivimäki M, Akbaraly T. Healthy dietary indices and risk of depressive outcomes: a systematic review and meta-analysis of observational studies. Mol Psychiatry. 2019 Jul;24(7):965- doi: 10.1038/s41380-018-0237-8.
34. Salari-Moghaddam A, Saneei P, Larijani B, Esmaillzadeh A. Glycemic index, glycemic load, and depression: a systematic review and meta-analysis. Eur. J. Clin. Nutr. 2019 Mar;73(3):356- doi: 10.1038/s41430-018-0258-z.
35. Kastorini CM, Milionis HJ, Esposito K, Giugliano D, Goudevenos JA, Panagiotakos DB. The effect of Mediterranean diet on metabolic syndrome and its components: a meta-analysis of 50 studies and 534,906 individuals. J. Am. Coll. Cardiol. 2011 Mar 15;57(11):1299- doi: 10.1016/j.jacc.2010.09.073.
36. Blondeau N. The nutraceutical potential of omega-3 alpha-linolenic acid in reducing the consequences of stroke. Biochimie. 2016 Jan;120:49- doi: 10.1016/j.biochi.2015.06.005.
37. Campos-Bedolla P, Walter FR, Veszelka S, Deli MA. Role of the blood-brain barrier in the nutrition of the central nervous system. Arch Med Res. 2014 Nov;45(8):610- doi: 10.1016/j.arcmed.2014.11.018.
38. Virmani A, Pinto L, Binienda Z, Ali S. Food, nutrigenomics, and neurodegeneration--neuroprotection by what you eat! Mol. Neurobiol. 2013 Oct;48(2):353-62. doi: 10.1007/s12035-013-8498-3.
39. Bjørklund G, Dadar M, Pen JJ, Chirumbolo S, Aaseth J. Chronic fatigue syndrome (CFS): Suggestions for a nutritional treatment in the therapeutic approach. Biomed Pharmacother. 2019 Jan;109:1000- doi: 10.1016/j.biopha.2018.10.076.
40. EFSA NDA Panel (EFSA Panel on Nutrition, Novel Foods and Food Allergens), Turck D, Bohn T, Castenmiller J, de Henauw S, Hirsch-Ernst KI, Knutsen HK, Maciuk A, Mangelsdorf I, McArdle HJ, Naska A, Peláez C, Pentieva K, Thies F, Tsabouri S, Vinceti M, Bresson J-L, Siani A. Scientific Opinion on the scientific advice related to nutrient profiling for the development of harmonised mandatory front-of-pack nutrition labelling and the setting of nutrient profiles for restricting nutrition and health claims on foods. EFSA Journal 2022; 20( 4):7259, 48 pp. https://doi.org/10.2903/j.efsa.2022.7259.
41. Maydych V. The Interplay Between Stress, Inflammation, and Emotional Attention: Relevance for Depression. Front Neurosci. 2019 Apr 24;13:384. doi: 10.3389/fnins.2019.00384.
42. Sublette ME, Ellis SP, Geant AL, Mann JJ. Meta-analysis of the effects of eicosapentaenoic acid (EPA) in clinical trials in depression. J. Clin. Psychiatry. 2011 Dec;72(12):1577- doi: 10.4088/JCP.10m06634.
43. Mozaffari-Khosravi H, Yassini-Ardakani M, Karamati M, Shariati-Bafghi SE. Eicosapentaenoic acid versus docosahexaenoic acid in mild-to-moderate depression: a randomized, double-blind, placebo-controlled trial. Eur Neuropsychopharmacol. 2013 Jul;23(7):636-44. doi: 10.1016/j.euroneuro.2012.08.003.
44. Lange K.W. Omega-3 fatty acids and mental health. Glob. Health. J. 2020,4:18-30. doi.org/10.1016/j.glohj.2020.01.004.
45. Gómez-Pinilla F. Brain foods: the effects of nutrients on brain function. Nat Rev Neurosci. 2008 Jul;9(7):568- doi: 10.1038/nrn2421. PMID: 18568016; PMCID: PMC2805706.
46. Jahangard L, Sadeghi A, Ahmadpanah M, Holsboer-Trachsler E, Sadeghi Bahmani D, Haghighi M, Brand S. Influence of adjuvant omega-3-polyunsaturated fatty acids on depression, sleep, and emotion regulation among outpatients with major depressive disorders — Results from a double-blind, randomized and placebo-controlled clinical trial. J. Psychiatr. Res. 2018 Dec;107:48- doi: 10.1016/j.jpsychires.2018.09.016.
47. Moritz B, Schmitz AE, Rodrigues ALS, Dafre AL, Cunha MP. The role of vitamin C in stress-related disorders. J Nutr Biochem. 2020 Nov;85:108459. doi: 10.1016/j.jnutbio.2020.108459.
48. Wang Y, Liu XJ, Robitaille L, Eintracht S, MacNamara E, Hoffer LJ. Effects of vitamin C and vitamin D administration on mood and distress in acutely hospitalized patients. Am. J. Clin. Nutr. 2013 Sep;98(3):705- doi: 10.3945/ajcn.112.056366.
49. Stringham NT, Holmes PV, Stringham JM. Supplementation with macular carotenoids reduces psychological stress, serum cortisol, and sub-optimal symptoms of physical and emotional health in young adults. Nutr. Neurosci. 2018 May;21(4):286-296. doi: 10.1080/1028415X.2017.1286445.
50. Gautam M, Agrawal M, Gautam M, Sharma P, Gautam AS, Gautam S. Role of antioxidants in generalised anxiety disorder and depression. Indian J Psychiatry. 2012 Jul;54(3):244- doi: 10.4103/0019-5545.102424.
51. Hoepner CT, McIntyre RS, Papakostas GI. Impact of Supplementation and Nutritional Interventions on Pathogenic Processes of Mood Disorders: A Review of the Evidence. Nutrients. 2021 Feb 26;13(3):767. doi: 10.3390/nu13030767.
52. Cheng YC, Huang YC, Huang WL. The effect of vitamin D supplement on negative emotions: A systematic review and meta-analysis. Depress Anxiety. 2020 Jun;37(6):549-564. doi: 10.1002/da.23025.
53. Richardson DP, Lovegrove JA. Nutritional status of micronutrients as a possible and modifiable risk factor for COVID-19: a UK perspective. Br. J. 2021 Mar 28;125(6):678-684. doi: 10.1017/S000711452000330X.
54. Young LM, Pipingas A, White DJ, Gauci S, Scholey A. A Systematic Review and Meta-Analysis of B Vitamin Supplementation on Depressive Symptoms, Anxiety, and Stress: Effects on Healthy and «At-Risk' Individuals. Nutrients. 2019 Sep 16;11(9):2232. doi: 10.3390/nu11092232.
55. Kennedy DO, Veasey R, Watson A, Dodd F, Jones E, Maggini S, Haskell CF. Effects of high-dose B vitamin complex with vitamin C and minerals on subjective mood and performance in healthy males. Psychopharmacology (Berl). 2010 Jul;211(1):55-68. doi: 10.1007/s00213-010-1870-3.
56. Macpherson H, Rowsell R, Cox KH, Scholey A, Pipingas A. Acute mood but not cognitive improvements following administration of a single multivitamin and mineral supplement in healthy women aged 50 and above: a randomised controlled trial. Age (Dordr). 2015 Jun;37(3):9782. doi: 10.1007/s11357-015-9782-0.
57. Allaert FA, Courau S, Forestier A. Effect of magnesium, probiotic, and vitamin food supplementation in healthy subjects with psychological stress and evaluation of a persistent effect after discontinuing intake. Panminerva Med. 2016 Dec;58(4):263- Epub 2016 Jun 16. PMID: 27309258.
58. Громова О.А., Торшин И.Ю., Калачева А.Г. Дотации магния для повышения резерва адаптации и стрессоустойчивости организма в период пандемии. РМЖ (Электронное издание), июль 2020. https://www.rmj.ru/articles/infektsionnye_bolezni/dotatsii-magniya-dlya-povysheniya-rezerva-adaptatsii-i-stressoustoychivosti-organizma-v-period-pandemii/
Gromova O.A., Torshin I.Yu., Kalacheva A.G. Magnesium subsidies to increase the body's adaptation reserve and stress resistance during a pandemic. BC (Electronic edition), July 2020 (in Russ.). https://www.rmj.ru/articles/infektsionnye_bolezni/dotatsii-magniya-dlya-povysheniya-rezerva-adaptatsii-i-stressoustoychivosti-organizma-v-period-pandemii.
59. Тарасов Е.А., Блинов Д.В., Зимовина У.В., Сандакова Е.А. Дефицит магния и стресс: вопросы взаимосвязи, тесты для диагностики и подходы к терапии. Терапевтический архив. 2015;87(9):114-122. https://doi.org/10.17116/terarkh2015879114-122
Tarasov EA, Blinov DV, Zimovina UV, Sandakova EA. Magnesium deficiency and stress: Issues of their relationship, diagnostic tests, and approaches to therapy. Terapevticheskii Arkhiv. 2015;87(9):114‑122 (in Russ.). https://doi.org/10.17116/terarkh2015879114-122.
60. Slutsky I, Abumaria N, Wu LJ, Huang C, Zhang L, Li B, Zhao X, Govindarajan A, Zhao MG, Zhuo M, Tonegawa S, Liu G. Enhancement of learning and memory by elevating brain magnesium. Neuron. 2010 Jan 28;65(2):165- doi: 10.1016/j.neuron.2009.12.026.
61. Noah L, Pickering G, Mazur A, Dubray C, Hitier S, Dualé C, Pouteau E. Impact of magnesium supplementation, in combination with vitamin B6, on stress and magnesium status: secondary data from a randomized controlled trial. Magnes Res. 2020 Aug 1;33(3):45- doi: 10.1684/mrh.2020.0468.
62. Стресс: причины и последствия, лечение и профилактика. Клинические рекомендации / Акарачкова Е.С., Байдаулетова А.И., Беляев А.А., Блинов Д.В, Громова О.А., Дулаева М.С., Замерград М.В, Исайкин А.И., Кадырова Л.Р., Клименко А.А., Кондрашов А.А., Косивцова О.В., Котова О.В., Лебедева Д.И., Медведев В.Э., Орлова А.С., Травникова Е.В., Яковлев О.Н. — СПб.: Скифия-принт; М.: Профмедпресс, 2020. — 138 с. Stress: causes and consequences, treatment and prevention. Clinical recommendations / Akarachkova E.S., Baidauletova A.I., Belyaev A.A., Blinov D.V., Gromova O.A., Dulaeva M.S., Zamergrad M.V., Isaikin A.I., Kadyrova L.R., Klimenko A.A., Kondrashov A.A., Kosivtsova O.V., Kotova O.V., Lebedeva D.I., Medvedev V.E., Orlova A.S., Travnikova E. V., Yakovlev O.N. St. Petersburg: Scythia-print; M.: Profmedpress, 2020.138 p. (in Russ.).
63. Каркищенко Н.Н., Каркищенко В.Н., Люблинский С.Л., Капанадзе Г.Д., Шустов Е.Б., Ревякин А.О., Болотских Л.А., Касинская Н.В., Станкова Н.В. Роль микроэлементов в спортивном питании и безопасность металлохелатов. Биомедицина. 2013;2:12-41. https://journal.scbmt.ru/jour/article/view/251/156. Karkischenko N.N., Karkischenko V.N., Lyublinskiy S.L., Kapanadze G.D., Shustov E.B., Revyakin A.O., Bolotskikh L.A., Kasinskaya N.V., Stankova N.V. Role of microcells in the sports nutrition and safety of metalchelates. Biomed. 2013;1(2):12-41 (in Russ.) https://journal.scbmt.ru/jour/article/view/251/156.
64. Domitrz I, Cegielska J. Magnesium as an Important Factor in the Pathogenesis and Treatment of Migraine-From Theory to Practice. Nutrients. 2022 Mar 5;14(5):1089. doi: 10.3390/nu14051089.
65. Bannai M, Kawai N. New therapeutic strategy for amino acid medicine: glycine improves the quality of sleep. J. Pharmacol. Sci. 2012;118(2):145- doi: 10.1254/jphs.11r04fm.
66. Sawada T, Yokoi K. Effect of zinc supplementation on mood states in young women: a pilot study. Eur. J. Clin. Nutr. 2010 Mar;64(3):331- doi: 10.1038/ejcn.2009.158.
67. Li Z, Li B, Song X, Zhang D. Dietary zinc and iron intake and risk of depression: A meta-analysis. Psychiatry Res. 2017 May;251:41- doi: 10.1016/j.psychres.2017.02.006.
68. Da Silva LEM, de Santana MLP, Costa PRF, Pereira EM, Nepomuceno CMM, Queiroz VAO, de Oliveira LPM, Machado MEPDC, de Sena EP. Zinc supplementation combined with antidepressant drugs for treatment of patients with depression: a systematic review and meta-analysis. Nutr. Rev. 2021 Jan 1;79(1):1-12. doi: 10.1093/nutrit/nuaa039.
69. Portugal-Nunes C, Castanho TC, Amorim L, Moreira PS, Mariz J, Marques F, Sousa N, Santos NC, Palha JA. Iron Status is Associated with Mood, Cognition, and Functional Ability in Older Adults: A Cross-Sectional Study. Nutrients. 2020 Nov 23;12(11):3594. doi: 10.3390/nu12113594.
70. Kapustin М.А., Chubavora А.S., Cigankov V.G., Kurchenko V.P. Isolation of curcuminoids from the Curcuma longa L and investigation of the composition of the obtained preparation using chromatographic methods of analysis. Proceedings of the Belarusian State University. 2016; 11(2):248-262. http://www.bio.bsu.by/proceedings/en/?act=7&id=542.
71. Ramaholimihaso T, Bouazzaoui F, Kaladjian A. Curcumin in Depression: Potential Mechanisms of Action and Current Evidence-A Narrative Review. Front Psychiatry. 2020 Nov 27;11:572533. doi: 10.3389/fpsyt.2020.572533.
72. Kanchanatawan B, Tangwongchai S, Sughondhabhirom A, Suppapitiporn S, Hemrunrojn S, Carvalho AF, Maes M. Add-on Treatment with Curcumin Has Antidepressive Effects in Thai Patients with Major Depression: Results of a Randomized Double-Blind Placebo-Controlled Study. Neurotox Res. 2018 Apr;33(3):621- doi: 10.1007/s12640-017-9860-4.
73. Lopresti AL, Drummond PD. Efficacy of curcumin, and a saffron/curcumin combination for the treatment of major depression: A randomised, double-blind, placebo-controlled study. J Affect Disord. 2017 Jan 1;207:188-196. doi: 10.1016/j.jad.2016.09.047.
74. Improved Oral Bioavailability of Curcumin Incorporated into Micelles 2016. (ClinicalTrials.gov Identifier: NCT01982734).
75. Комарова О.Н., Хавкин А.И. Взаимосвязь стресса, иммунитета и кишечной микробиоты. Педиатрическая фармакология. 2020;17(1):18-24. doi: 10.15690/pf.v17i1.2078. Komarova О.N., Khavkin A.I. Correlation Between Stress, Immunity and Intestinal Microbiota. Pediatricheskaya farmakologiya — Pediatric pharmacology. 2020;17(1):18-24 (in Russ.). doi: 10.15690/pf.v17i1.207.
76. Акарачкова Е.С., Котова О.В., Кадырова Л.Р. Эпидемия Covid-19. Стресс-связанные последствия: учебное пособие, 2020.
Akarachkova E.S., Kotova O.V., Kadyrova L.R. Covid-19 epidemic. Stress related consequences. Tutorial, 2020 (in Russ.).
77. Chen Y, Gu S, Chen Y, Lu H, Shi D, Guo J, Wu WR, Yang Y, Li Y, Xu KJ, Ding C, Luo R, Huang C, Yu L, Xu M, Yi P, Liu J, Tao JJ, Zhang H, Lv L, Wang B, Sheng J, Li L. Six-month follow-up of gut microbiota richness in patients with COVID-19. Gut. 2022 Jan;71(1):222- doi: 10.1136/gutjnl-2021-324090.
78. Peng J, Zhang M, Yao G, Kwok LY, Zhang W. Probiotics as Adjunctive Treatment for Patients Contracted COVID-19: Current Understanding and Future Needs. Front Nutr. 2021 Jun 10;8:669808. doi: 10.3389/fnut.2021.669808.
79. Meijer K, de Vos P, Priebe MG. Butyrate and other short-chain fatty acids as modulators of immunity: what relevance for health? Curr. Opin. Clin. Nutr. Metab. Care. 2010 Nov;13(6):715-21. doi: 10.1097/MCO.0b013e32833eebe5.
80. Каштанова Д.А., Егшатян Л.В., Ткачева О.Н. Участие микробиоты кишечника человека в процессах хронического системного воспаления. Клин. микробиол. антимикроб. химиотер. 2015;17(4):310-317.
Kashtanova D.A., Egshatyan L.V., Tkacheva O.N. The Involvement of Human Gut Microbiota in Chronic Systemic Inflammation. Clinical microbiology and antimicrobial chemotherapy. 2015;17(4):310-317 (in Russ.) https://www.researchgate.net/publication/312523645_The_Involvement_of_Human_Gut_Microbiota_in_Chronic_Systemic_Inflammation/stats#fullTextFileContent.
81. Taylor AM, Holscher HD. A review of dietary and microbial connections to depression, anxiety, and stress. Nutr Neurosci. 2020 Mar;23(3):237- doi: 10.1080/1028415X.2018.1493808.
82. Liu G, Chong HX, Chung FY, Li Y, Liong MT. Lactobacillus plantarum DR7 Modulated Bowel Movement and Gut Microbiota Associated with Dopamine and Serotonin Pathways in Stressed Adults. Int. J. Mol. Sci. 2020 Jun 29;21(13):4608. doi: 10.3390/ijms21134608.
83. Chong HX, Yusoff NAA, Hor YY, Lew LC, Jaafar MH, Choi SB, Yusoff MSB, Wahid N, Abdullah MFIL, Zakaria N, Ong KL, Park YH, Liong MT. Lactobacillus plantarum DR7 alleviates stress and anxiety in adults: a randomised, double-blind, placebo-controlled study. Benef Microbes. 2019 Apr 19;10(4):355-373. doi: 10.3920/BM2018.0135
|
Сведения об авторах
1. ФГАОУ ВО «Российский университет дружбы народов», Москва. Автор для переписки: Орлова Светлана Владимировна. E-mail: rudn_nutr@mail.ru. |
|
About authors
1. Russian University of Peoples' Friendship, Moscow, Russia. Corresponding author: Orlova Svetlana V. E-mail: rudn_nutr@mail.ru |
Материал партнера: «Эвалар»















